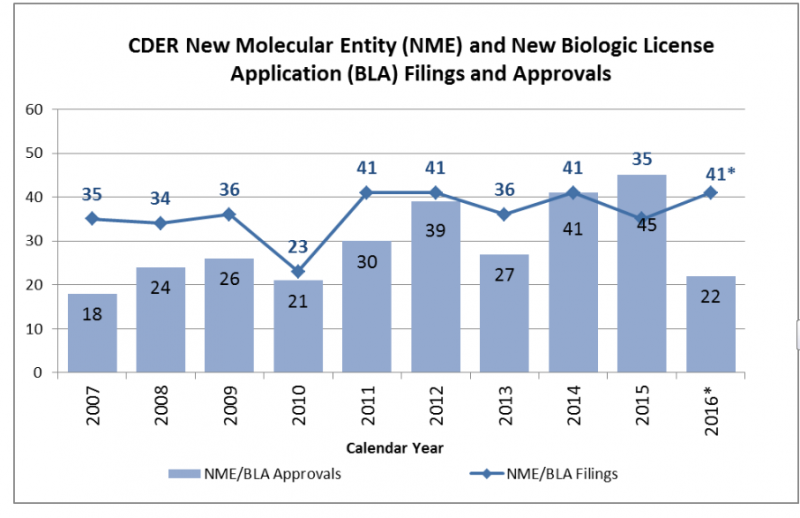
La FDA publicó su informe anual que resume las aprobaciones del 2016. Durante el año que terminó de cerrar, el organismo le dio el visto bueno a tan sólo 22 drogas nóveles. Esto representa menos de la mitad de las aprobadas en el 2015.
La FDA publicó su informe anual que resume la cantidad y características de las moléculas innovadoras aprobadas durante el 2016. Ver documento.
El organismo explica en un documento que el año que cerró dio a luz 22 drogas nóveles. Parece mucho. Pero son menos de la mitad que las que el organismo regulatorio aprobó en el año 2015 en los Estados Unidos. Ver artículo.
Claro que dicho año había marcado el récord de la década, con 45 nuevos productos avalados en ese país. Ver abajo.
En este 2016 que concluyó, las multis que picaron en punta fueron las norteamericanas Eli Lilly; Biogen; y MSD, que sumaron dos productos cada una al panel de novedades. Biogen obtuvo el OK para Zinbryta, para la esclerosis múltiple; y Spinraza, para la atrofia muscular espinal.
Hubo tres laboratorios que picaron en punta. Fueron Biogen; Eli Lilly; y MSD. Cada uno de ellos sumó dos productos. Biogen recibió el aval para Spinraza, para la atrofia muscular espinal y Zinbryta, para la esclerosis múltiple. Eli Lilly consiguió el OK para el oncológico Lartruvo y Taltz, para psoriasis. Y MSD recibió la aprobación para Zepatier, para hepatitis C, y Zinplava para infecciones.
Mientras que Eli Lilly consiguió el aval para el oncológico inyectable Lartruvo; y para Taltz indicado en psoriasis. La norteamericana MSD, en tanto, recibió la aprobación para Zepatier, un producto para hepatitis C; y Zinplava para reducir la recurrencia de la infección por clostridium difficile.
Otras que lograron sumar nuevos productos al mercado fueron la suiza Roche con su oncológico Tecentriq; Abbvie con Venclexta para la leucemia linfocítica crónica; y la irlandesa Shire con Xiidra para tratar el ojo seco.
También la francesa Sanofi con Adlyxin, un inyectable para el tratamiento de la diabetes tipo 2; y la israelí Teva que coló Cinqair para el asma.
En esta tanda anual de aprobaciones sin dudas, una de las protagonistas fue la hepatitis C. Hubo tres compañías que le apuntaron directo. Fueron las norteamericanas Gilead; MSD y Anacor con Epclusa; Zepatier; y Eucrisa, respectivamente.
La lista de 22 drogas se completa con productos de otras empresas de menor peso y alcance geográfico. Son: Exondys 51 de Sarepta; Anthim de Elusys; Rubraca, de Clovis Oncology; Netspot, de Advanced Accelerator Aplications USA.
Los laboratorios siguen apuntando sus cañones a los «raros» y los oncológicos. Por eso fueron una vez más las «vedettes» del 2016. La FDA le dio el visto bueno a nueve productos para el tratamiento de Enfermedades Raras. Mientras que en Onco, surgieron ocho nuevas moléculas.
También Axumin de Blue Earth Diagnostics; Briviact de UCB; Defitelio de Jazz Pharmaceuticals; Nuplazid, de Acadia; y Ocaliva de Intercept. Ver listado completo.
Enfermedades Raras y Oncología
Una vez más, las estrellas del 2016 fueron las Enfermedades Raras y la Oncología. El segmento de Enfermedades Raras trajo nueve productos, entre ellos, un notable que resalta la FDA, es Spinraza de Biogen; y Exondys 51, de Sarepta, para tratar la distrofia muscular de Duchenne.
Los cañones también estuvieron súper apuntados para la Oncología. En el 2016 surgieron ocho nuevas moléculas para este segmento.
¿Las destacadas? Lartruvo, de Eli Lilly, indicada para sarcoma de tejidos blandos; Tecentriq de Roche, para tratar cáncer de vejiga; Venclexta de Abbvie, para leucemia linfocítica crónica; y Rubraca, de Clovis, para cáncer de ovario.
Sin duda este listado reviste una gran importancia en función de que la FDA siempre se transforma en el faro para las aprobaciones de los diferentes organismos regulatorios de la región.
Además, recibieron el OK dos agentes de diagnóstico: Axumin, para detectar cáncer de próstata; y Netspot, para dar con tumores neuroendocrinos raros.
Mecanismos de aprobación
La FDA utiliza diferentes vías para acortar el tiempo de desarrollo y aprobación de las nuevas drogas.
Según detalla el informe, muchos fármacos reciben una «revisión prioritaria» y el producto se revisa en un plazo de seis meses. De hecho, 15 de las 22 moléculas aprobadas durante el 2016 recibieron esta designación. Entre ellos se encuentran: Tecentriq; Lartruvo; Venclexta; Xiidra; Zepatier; Zinplava; Epclusa; Rubraca; Axumin; Defitelio, Exondys 51; Netspot; Nuplazid; y Ocaliva.
Para acortar el tiempo de aprobación, la FDA le concede a muchos productos la «revisión prioritaria». Durante el 2016, un total de 15 drogas fueron encarpetadas en esta clasificación.
Otro camino que utiliza el organismo es el designado como «Fast Track» para su pronta revisión. En total, ocho productos fueron encarpetados en esta categoría. Son Anthim, Defitelio, Epclusa, Exondys 51, Lartruvo, Ocaliva, Spinraza, y Zinplava.
Asimismo, muchos fármacos reciben la etiqueta de «Breakthrough». De hecho, siete de las nuevas moléculas del 2016 corrieron por este andarivel. Se incluyeron a Epclusa, Lartruvo, Nuplazid, Rubraca, Tecentriq, Venclexta, y Zepatier.
Por último, a través de la vía llamada «aprobación acelerada» la FDA aprobó seis productos. Se trató de Exondys 51, Lartruvo, Ocaliva, Rubraca, Tecentriq, y Venclexta.