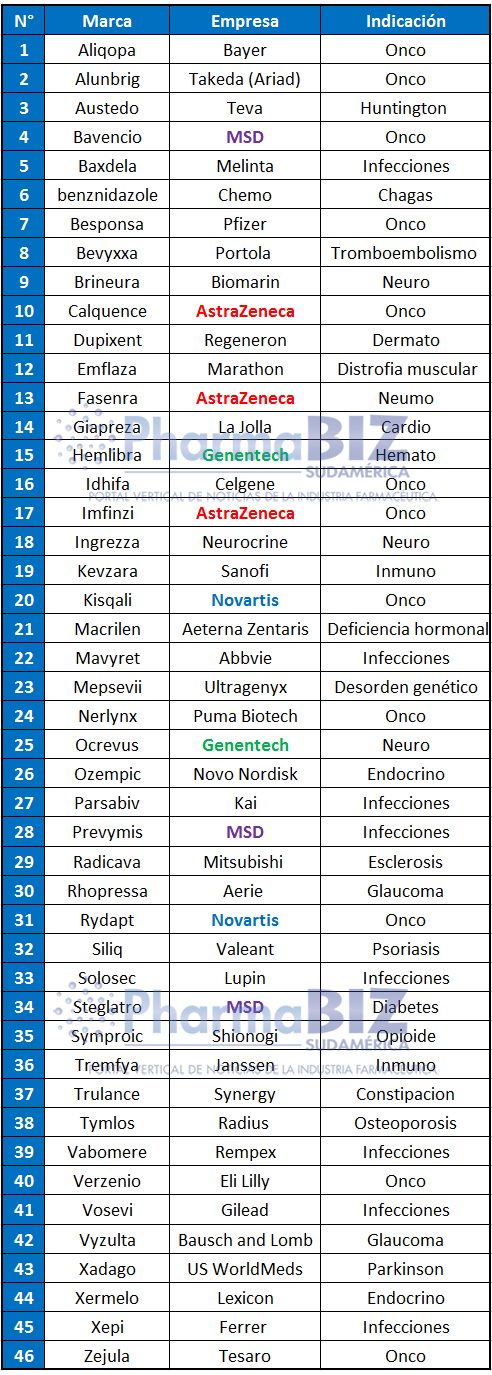
La FDA emitió su informe de aprobaciones 2017. Allí mostró que el 2017 fue un año record con 46 nuevos productos avalados para salir al mercado. Resalta por caso, Hemlibra, el primer producto no sanguíneo para tratar a pacientes con hemofilia tipo A con inhibidores, perteneciente a la suiza Roche.
La FDA publicó su informe anual que resume la cantidad y características de las moléculas innovadoras aprobadas durante el 2017. Ver informe
El organismo batió un record y le dio el visto bueno a 46 drogas nóveles. Son más del doble que las aprobadas en el 2016, y superan a las 45 que había avalado en el 2015, y que marcaban, hasta ahora, la cifra más alta de la década. Ver artículo
La FDA destacó que en el 2017 las Enfermedades Raras picaron en punta. Por caso, la agencia regulatoria le levantó el pulgar a Hemlibra, que lleva el sello de la suiza Roche, el primer producto no sanguíneo para tratar a pacientes con hemofilia tipo A con inhibidores. También obtuvo el visto bueno Brineura, de la norteamericana BioMarin, para tratar una forma específica de la enfermedad de Batten que también recibió la designación de droga huérfana.
Mientras que en la Argentina AstraZeneca está en declive, en Estados Unidos obtuvo el visto bueno para 3 productos. Son Calquence, para linfoma de células de manto; Imfinzi, para cáncer de vejiga avanzado; y Fasenra, para el asma severa.
Oncología, a tope
Según el informe, durante el año pasado la FDA respaldó a 12 oncológicos. Entre ellos resalta Kisqali, de la suiza Novartis, indicado para cáncer de mama metastásico. Otros dos productos avalados para cáncer de mama fueron Verzenio, de la norteamericana Eli Lilly; y Nerlynx de Puma Biotechnology.
Mientras en la Argentina está en declive, en Estados Unidos AstraZeneca tuvo respaldados 3 productos. Fueron Calquence, un medicamento huérfano para el tratamiento del linfoma de células de manto; Imfinzi, para un tipo de cáncer de vejiga avanzado; y Fasenra, el primer biológico respiratorio indicado para el asma severa.
Drogas huérfanas
Además de AZ, hay una tríada de laboratorios que lograron más de un aval en el 2017. Se trata de las suizas Roche y Novartis, y la norteamericana MSD.
En el año que cerró, 18 de los 46 medicamentos nuevos recibieron el OK bajo la designación de drogas huérfanas, muchos de ellos son oncológicos. En el listado figuran: Aliqopa, de la alemana Bayer, para linfoma folicular recidivante; Alunbrig, que pasó a manos de Takeda luego de que adquiriera a Ariad, para cáncer de pulmón metastásico; Austedo, de la israelí Teva, para la corea asociada con la enfermedad de Huntington; Bavencio, de la alemana Merck, para el carcinoma de células de Merkel metastásico; y Besponsa, de Pfizer, para la leucemia linfoblástica aguda refractaria.
El año pasado, 18 de los 46 medicamentos nuevos recibieron el OK bajo la designación de drogas huérfanas, muchos de ellos son oncológicos. En el listado resaltan Aliqopa, de Bayer; Alunbrig, de Takeda; Bavencio, de Merck; y Besponsa, de Pfizer, entre otros.
También obtuvo la venia de la FDA benznidazol, el primer tratamiento aprobado en Estados Unidos para la Enfermedad de Chagas, que lleva el sello del Grupo Chemo, propiedad de Hugo Sigman, y que en la Argentina se comercializa con el nombre de Abarax, bajo el paraguas de Elea.
Otros productos que tuvieron luz verde como drogas huérfanas fueron Emflaza, de Marathon, para la distrofia muscular de Duchenne; Idhifa, de Celgene, para leucemia mieloide aguda refractaria; Macrilen, de Aeterna Zentaris, para el diagnóstico de la deficiencia de la hormona de crecimiento; Mepsevii, de Ultragenyx, para el síndrome de Sly; Prevymis, de MSD, para prevenir una infección grave, en adultos que reciben un tipo de trasplante de células madre.
También fueron de la partida Radicava, de Mitsubishi Pharma, para esclerosis lateral amiotrófica; Rydapt, de Novartis, para la leucemia mieloide aguda; Xermelo, de Lexicon, para el síndrome carcinoide; y Zejula, de Roche, para cáncer de ovario epitelial recurrente.
Asimismo, la agencia regulatoria de los EE.UU. aprobó ocho productos para tratar Infecciones. Además de Prevymis, de MSD, obtuvieron el sí Mavyret, de Abbvie, para hepatitis C crónica; Vosevi, de Gilead, para hepatitis C crónica sin cirrosis; Baxdela, de Melinta, para infecciones agudas de la piel; y Solosec, de Symbiomix, para el tratamiento de la vaginosis bacterial. También Parsabiv, de Kai, para hiperparatiroidismo secundario en pacientes adultos con riñón crónico en hemodiálisis; Vabomere de Rempex, para infecciones urinarias complicadas; y Xepi, un tratamiento tópico para el impétigo perteneciente a Ferrer.
En el segmento de Dermatología se destacó el primer y único medicamento biológico aprobado para eczema. Se trata de Dupixent, que lleva el sello de Sanofi Genzyme y Regeneron. Ambas firmas también recibieron el OK para Kevzara, para artritis reumatoidea. A la vez que en Inmuno también alcanzaron el sí Tremfya de Janssen, y Siliq, de Valeant, ambos indicados para tratar la psoriasis.
Por último, en diabetes los protagonistas fueron MSD con Steglatro, para diabetes tipo 2; y la danesa Novo Nordisk con Ozempic, indicado como un complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes tipo 2.
Medicinas disruptivas
En el lote de las terapias disruptivas –Breakthrough Therapy– entraron: Alunbrig, de Takeda; Bavencio y Prevymis, de MSD; Besponsa, de Pfizer; Brineura, de BioMarin; Calquence e Imfinzi, de AZ; Dupixent, de Sanofi; y Hemlibra y Ocrevus, de Roche.
También Ingrezza, de Neuricrine; Kisqali y Rydapt, de Novartis; Mavyret, de Abbvie; Verzenio, Eli Lilly; Vosevi, de Gilead; y Zejula, de Tesaro.