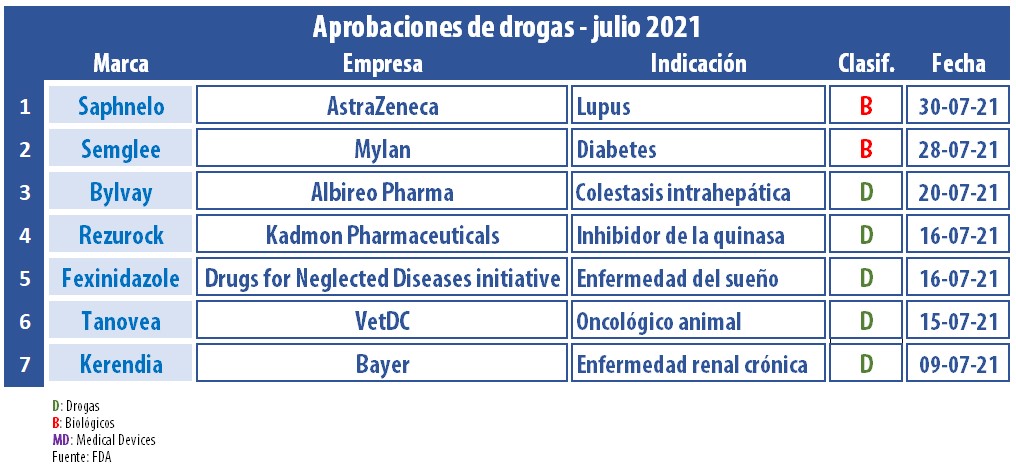
El mes de julio se dio por cerrado y Pharmabiz pone una lupa sobre todo lo aprobado durante el ciclo. Resaltaron un oncológico para linfomas en perros y el primer biosimilar de Lantus, la insulina de Sanofi.
Durante este mes de julio, la FDA le dio luz verde al primer biosimilar de Lantus, la insulina análoga lenta de la francesa Sanofi. Se trata de Semglee, para el control glucémico en adultos y niños con diabetes mellitus tipo 1 y en adultos con diabetes mellitus tipo 2. El producto es de Mylan Pharmaceuticals, firma que en noviembre pasado se unió a la división Upjohn de Pfizer para dar lugar a Viatris. Ver artículo «FDA aprueba primer biosimilar de Lantus» / Ver artículo «Pfizer completó merger, nace Viatris».
La británica AstraZeneca también se llevó un aval. Fue al filo del cierre de julio cuando la FDA le levantó el pulgar a Saphnelo, un anticuerpo «first in class» receptor del interferón I que fue clasificado como el primer medicamento nuevo en más de una década para lupus eritematoso sistémico. Este biológico está indicado para adultos que estén recibiendo terapia standard. Ver Press Release.
En el arranque del mes, la alemana Bayer consiguió el OK para Kerendia. Se trata de un medicamento a base de finerenone, para adultos con enfermedad renal crónica asociada con diabetes tipo 2. El mismo está indicado para reducir el riesgo de deterioro de la función renal, insuficiencia renal, hospitalización por insuficiencia cardíaca y muerte cardiovascular. Ver Press Release.
La agencia le dio el OK también a Rezurock, de la norteamericana Kadmon Pharmaceuticals, para mayores de 12 años con enfermedad crónica de injerto contra huésped. El tratamiento, indicado en personas que hayan recibido dos terapias sistémicas, fue avalado bajo revisión prioritaria y obtuvo la designación de terapia disruptiva. La aprobación se dio en el marco del Proyecto Orbis -para el que en esta oportunidad la FDA colaboró con sus pares de Australia, Canadá, Suiza y Reino Unido- y del programa piloto Real-Time Oncology Review. Ver Press Release FDA. Ver Press Release Kadmon.
Otro producto que recibió la venia en este mes de julio fue Fexinidazole. El medicamento, que fue desarrollado por la ONG Drugs for Neglected Diseases Iniciative, en conjunto con la francesa Sanofi y otros partners africanos, ya había conseguido el visto bueno de la EMA en el 2018. La nueva molécula se constituyó en la primera terapia oral para la enfermedad del sueño, la cual es provocada por dos tipos de parásitos y trasmitida por la mosca tse-tsé, al igual que el Chagas. Ver Press Release Sanofi.
Albireo Pharma, que nació de mano de la norteamericana AstraZeneca en el 2008, obtuvo la aprobación para Bylvay, y así marcó su primer registro en la FDA. De acuerdo con la compañía, se trata de un inhibidor no sistémico del transporte de ácidos biliares ileales, el cual se ubica como la primera terapia para el prurito en todos los casos de colestasis intrahepática familiar progresiva (PFIC). El mismo fue avalado bajo la etiqueta de revisión prioritaria de enfermedades pediátricas raras. Ver Press Release Albireo.
Por otra parte, la FDA le está poniendo fichas a su programa MUMS, a fin de alentar a las farmacéuticas en el desarrollo de medicamentos para animales de demanda limitada. En ese marco, le levantó el pulgar a Tanovea, de la norteamericana VetDC, para el tratamiento de linfomas en perros. Es un inyectable a base de rabacfosadina. Ver «Tanovea con OK para linfomas, perros».