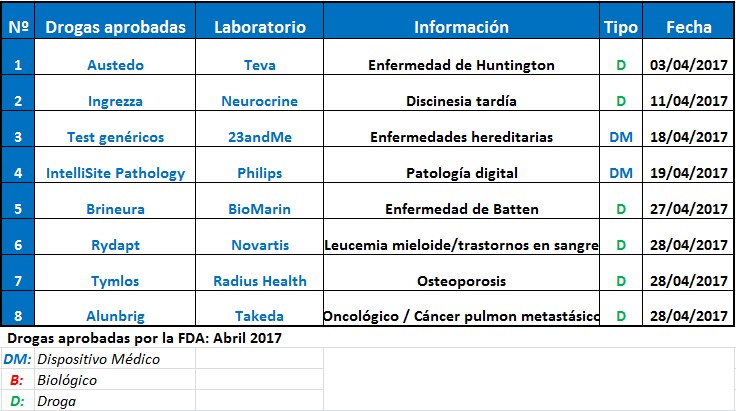
La suiza Novartis recibió el aval para Rydapt, indicado para tratar la leucemia mieloide aguda y los trastornos en sangre.
La FDA aprobó seis nuevas moléculas y dos dispositivos médicos durante el mes de abril.
Entre las compañías que lograron el visto bueno del organismo regulatorio de los Estados Unidos, se destacó la suiza Novartis con Rydapt. El producto -que obtuvo el aval como terapia muy importante y revisión prioritaria- tiene dos indicaciones: leucemia mieloide aguda y trastornos en sangre.
La japonesa Takeda consiguió el OK para su oncológico Alunbrig. Mientras, la FDA también le levantó el pulgar a la israelí Teva, fue para Austedo, asociado con la enfermedad de Huntington.
La israelí Teva también consiguió el OK de la FDA. Fue para Austedo, un tratamiento para la corea asociada con la enfermedad de Huntington. La japonesa Takeda, en cambio, logró el respaldo para su oncológico Alunbrig, para cáncer de pulmón metastásico.
Otra firma que tuvo la venia de la FDA fue el laboratorio norteamericano BioMarin, con su producto huérfano Brineura. El mismo está indicado para el tratamiento de una forma específica de la enfermedad de Batten. Ver artículo.
Además, el organismo de los Estados Unidos le levantó el pulgar a la biotecnológica Neurocrine para Ingrezza, una terapia innovadora que trata la discinesia tardía, un trastorno neurológico. También le dio luz verde a Tymlos, de la firma Radius Health. El producto está indicado para tratar la osteoporosis en mujeres posmenopáusicas. Ver artículo.
En materia de medical devices, la holandesa Philips obtuvo aprobación para Philips IntelliSite Pathology Solution, el primer sistema completo de imágenes de diapositivas para patología digital. Ver artículo.
Asimismo, la empresa 23andMe recibió el aval para los tests genéticos que permiten detectar 10 enfermedades hereditarias sin que el individuo tenga que hacer una consulta previa con un médico. Ver artículo.