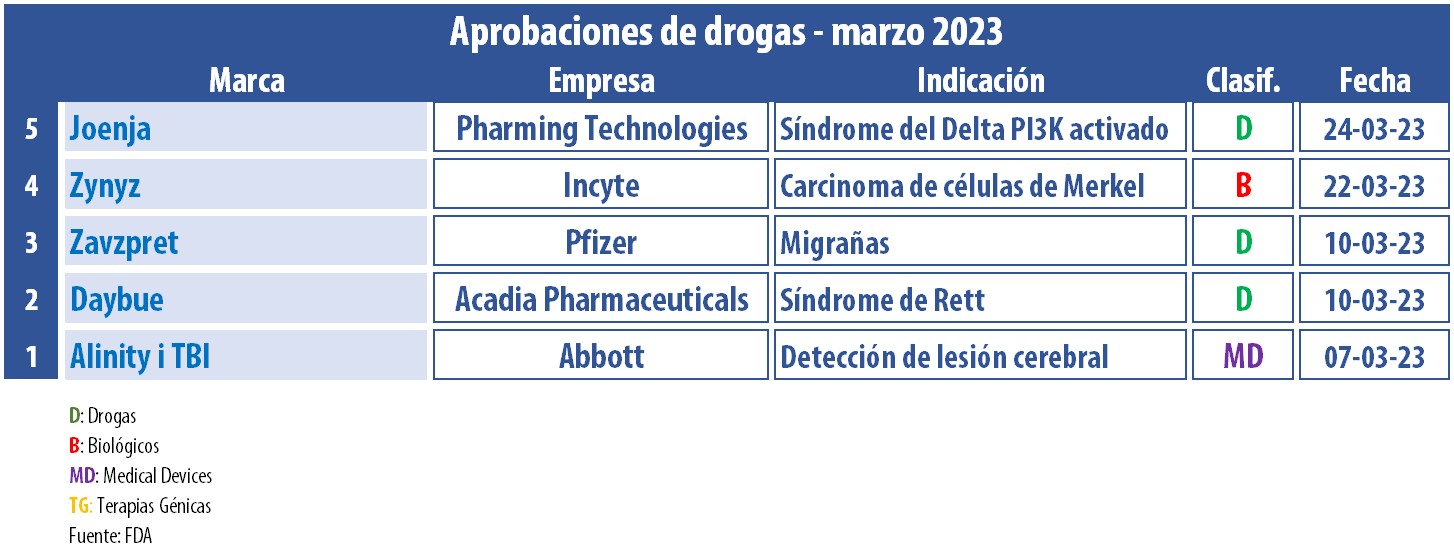
En marzo, y como cada mes, desde Pharmabiz, se pasa revista al panel de aprobaciones de la FDA. En este nuevo informe, surgen novedades relevantes y para un amplio espectro de indicaciones.
En el tercer mes del año, las aprobaciones de la FDA no pierden el ritmo. En Pharmabiz, realizamos un repaso de todos los avales.
Uno de las aprobaciones destacadas del mes fue Zavzpret, de la estadounidense Pfizer. Se trata del primer spray nasal indicado para la migraña, que puede aliviar el dolor en 15 minutos. El producto está indicado para adultos para su uso tanto para tratamiento agudo como preventivo. La multi anunció que Zavzpret estará disponible en farmacias a partir de julio. Ver Press Release.
A su vez, Daybue, de la norteamericana Acadia Pharmaceuticals, recibió el OK del organismo regulador. El producto está indicado para mayores de dos años con síndrome de Rett -un desorden neurológico raro, que afecta principalmente a mujeres, y que incide en el desarrollo cerebral. A base de trofinetide, Daybue recibió la designación de droga huérfana, y comenzará a comercializarse a partir de abril del 2023. Ver Press Release.
Otro medicamento que obtuvo el aval de la FDA fue Joenja, de Pharming Technologies. Se trata del primer tratamiento para APDS, el síndrome de fosfoinositida 3-quinasa delta activada, y a base de leniolisib. Se estima que el producto se lance en EE.UU. a principios de abril. Ver Press Release Pharming.
En paralelo, casi al cierre de marzo la FDA le concedió la aprobación acelerada a Zynyz, de Incyte Corporation, para carcinoma de células de Merkel. El anticuerpo monoclonal a base de retifanlimab recibió revisión prioritaria, vía rápida y designación de medicamento huérfano por parte del regulador. La compañía detalló que el producto también se está probando en otros tipos de tumores. Ver Press Release FDA / Ver Press Release Incyte.
La FDA le dio luz verde, asimismo, al test de sangre Alinity i TBI, de la norteamericana Abbott. El mismo fue diseñado para identificar lesiones cerebrales traumáticas (conmoción cerebral, o TBI por sus siglas en inglés), y es el primero en su tipo. La prueba mide dos indicadores en la sangre que, en concentraciones elevadas, están estrechamente relacionados con una lesión cerebral. Abbott explica que el producto le permitirá a los médicos descartar la necesidad de una tomografía computada en pacientes con concusiones leves. Ver artículo Abbott.