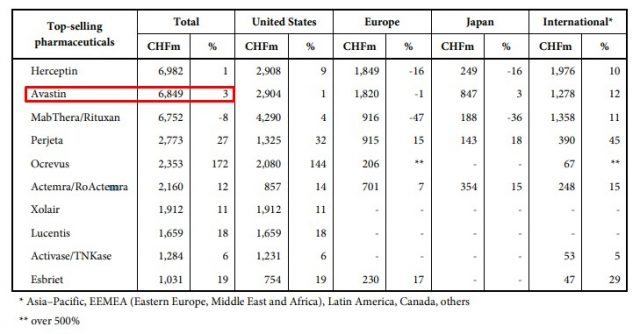
La FDA aprobó Zirabev de Pfizer, el segundo biosimilar del oncológico Avastin de la suiza Roche. La EMA ya le había levantado el pulgar a este producto en Europa en febrero de este año.
La FDA le levantó el pulgar al segundo biosimilar del oncológico Avastin, uno de los productos estrella de la suiza Roche. Se trata de Zirabev el que pertenece a la norteamericana Pfizer. Ver press release.
El primer medicamento que tomó como referencia a Avastin había sido Mvasi un tratamiento que lleva el sello de la norteamericana Amgen, y que recibió el OK en septiembre del 2017. Ver artículo.
Zirabev, que se convirtió en el 21º bioequivalente aprobado por el organismo, fue autorizado para cinco indicaciones, por caso, para cáncer colorrectal metastásico y cáncer cervical. Ver infografía.
En paralelo, la EMA lleva avalada la misma cantidad de copias de Avastin que su par de Estados Unidos, y en febrero de este año ya le había dado luz verde a este producto de Pfizer. Aunque en términos generales, la agencia europea le concedió el OK a más del doble de biosimilares. Ver artículo.