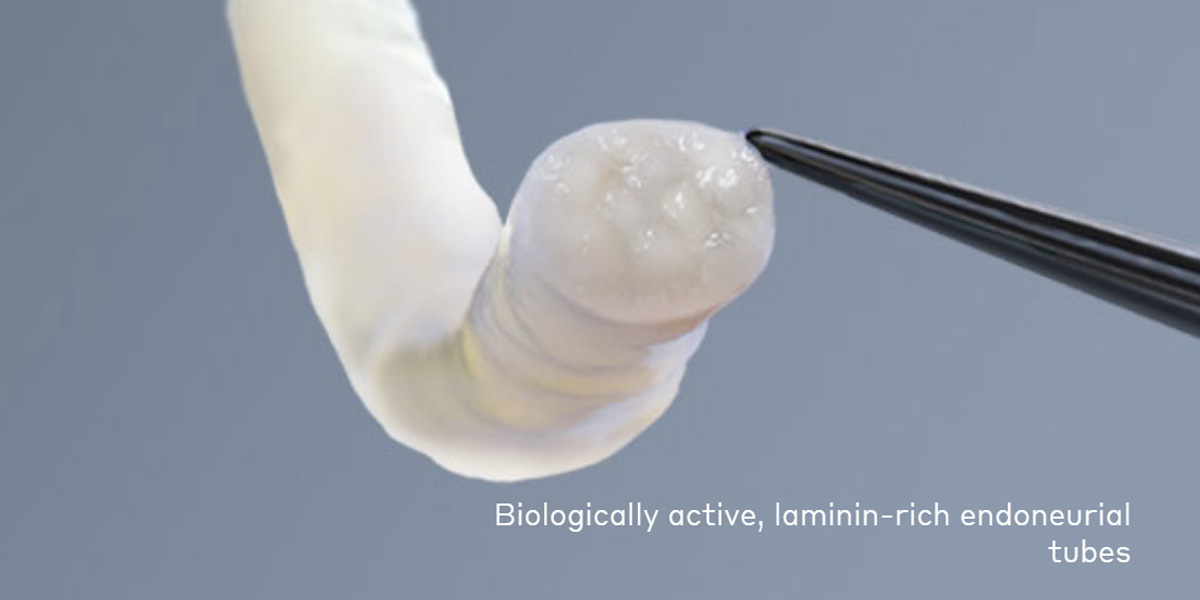
La FDA aprobó un injerto de reparación nerviosa para reparar los nervios periféricos dañados sin la necesidad de una segunda cirugía para extraer tejido nervioso del paciente. El aval para Avance, de Axogen, representa un cambio de clasificación para un producto basado en el tejido humano.
Axogen, una empresa de Florida, EE.UU, especialista en la tecnología quirúrgica y medicina regenerativa recibió el aval de la FDA para Avance, un andamiaje para el tratamiento de discontinuidades del nervio sensorial. El injerto de reparación nerviosa permite regenerar los nervios periféricos dañados sin necesidad de una segunda cirugía. Ver Press Release
A diferencia de los autoinjertos tradicionales, que requieren la extracción de tejido nervioso sano de otra parte del cuerpo del paciente, Avance utiliza tejido nervioso de un donante. El tejido que está procesado para extraer células, preservando la estructura natural esencial para la regeneración nerviosa. Axogen dice que reduce las complicaciones y favorece una recuperación más rápida.
El tratamiento se clasificaba anteriormente como tejido humano donado. Con la aprobación de la FDA como producto biológico, ahora se considerará para el tratamiento de discontinuidades nerviosas sensoriales en pacientes adultos y pediátricos de un mes o más. Michael Dale, director ejecutivo de Axogen, afirmó que la nueva clasificación representa un cambio significativo. Ver Press Release
Las lesiones de los nervios periféricos son daños a los nervios fuera del cerebro y la médula espinal. Pueden causar síntomas como dolor, entumecimiento, debilidad y pérdida de función en las zonas afectadas.
La aprobación de la FDA podría otorgar a Avance 12 años de exclusividad en el mercado estadounidense y permitir una mayor cobertura de seguros a medida que más médicos empiecen a usarlo como tratamiento. Se espera que las ventas comerciales comiencen a principios del segundo trimestre de 2026. Hasta entonces, Avance seguirá ofreciéndose bajo la clasificación de tejido humano.