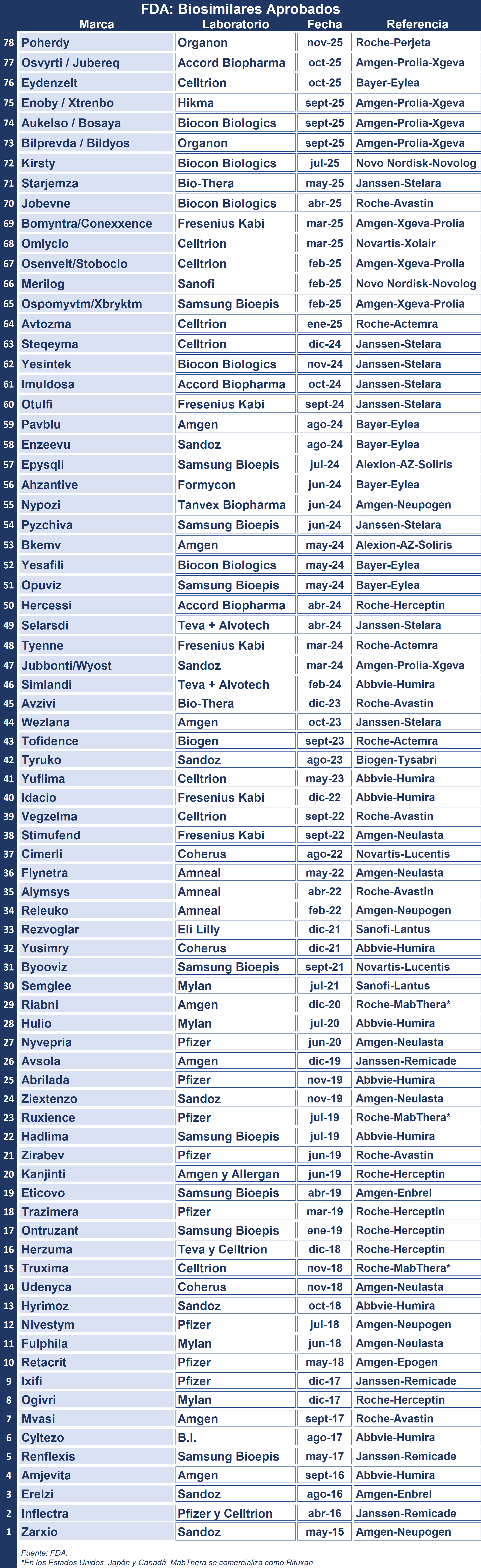
Hoy Poherdy, basado en pertuzumab, se convirtió en el primer biosimilar aprobado de Perjeta, de la suiza Roche. Esto se da en el marco de las políticas para la aceleración de la autorización de biosimilares por parte de las cabezas actuales de la FDA.
Los biosimilares se mantienen como un punto clave en la industria farmacéutica. Y hoy Perjeta, el citostático para el cáncer de mama metastásico HER2 positivo de la suiza Roche, se une a la lista de biológicos con opciones alternativas. Ver Press Release
En este caso Poherdy, basado en pertuzumab, y registrado a nombre de la norteamericana Organon y fabricado por la china Shanghai Henlius Biotech, se convirtió en el primer reemplazo avalado para Perjeta.
Asimismo, en octubre se registró el visto bueno a otros dos biosimilares. Por un lado, Celltrion consiguió el OK para Eydenzelt, el que se constituye en el sexto bio de Eylea, de la alemana Bayer. Y el exitoso tandem Prolia y Xgeva, de la norteamericana Amgen, también tiene una nueva pareja de bios, Osvyrti y Jubereq, de su connacional Accord. Ver Press Release Celltrion
Este año, la conducción de la FDA informó de una serie de medidas diseñadas para aumentar la disponibilidad de biosimilares en EE.UU y reducir el precio de los medicamentos biológicos una vez que pierdan la protección de patente. Esto incluye cambios como reducir la carga de las pruebas clínicas para los biosimilares, a la vez que categorizar a todos los biosimilares aprobados como intercambiables. Ver FDA: medidas para promover el acceso a biosimilares
Nota: en Pharmabiz no nos apoyamos en la inteligencia artificial para el armado de los artículos. Nuestro equipo de periodistas profesionales coteja y redacta cada dato.