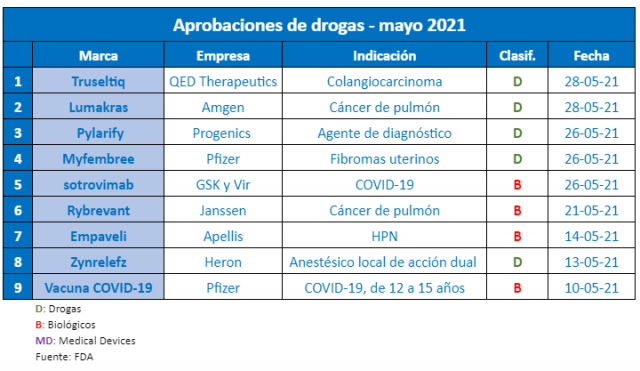
En el quinto mes de este 2021, la FDA continuó aprobando productos que apuntan tanto a la pandemia del COVID-19, como al tratamiento de otras condiciones extra coronavirus. Así la agencia norteamericana emitió al menos nueve avales de relevancia.
Para la FDA no todo es COVID-19. El organismo regulatorio también tiene la lupa puesta en productos para enfermedades por fuera de la pandemia. Por caso, en este mayo fueron nueve las aprobaciones de relevancia, de las cuales dos apuntaban al coronavirus.
En el quinto mes del año, el segmento de Onco volvió a tomar protagonismo. La FDA le dio luz verde a Rybrevant, de la norteamericana Janssen. Este biológico fue calificado como el primer tratamiento para adultos con cáncer de pulmón de células no pequeñas, cuyos tumores presenten cierta mutación genética. Ver «FDA aprueba Rybrevant de Janssen, Onco».
Y en sintonía, la agencia también le dio el sí a Lumakras, de la estadounidense Amgen. El producto está indicado para adultos con cáncer de pulmón de células no pequeñas cuyos tumores tengan cualquier mutación genética de KRAS -incluido un tipo específico denominado KRAS G12C– y que hayan recibido al menos una terapia sistémica previa. Ver «FDA aprobó Lumakras de Amgen».
A su vez en el segmento de Onco la australiana QED Therapeutics completó la lista de aprobaciones. La firma consiguió el respaldo para Truseltiq, un inhibidor de la cinasa para adultos con colangiocarcinoma irresecable, metastásico o localmente avanzado, que haya sido previamente tratado. Ver Press Release FDA. Ver Press Release QED.
Otro que recibió la venia fue Pylarify, de la norteamericana Progenics. Se trata de un agente de diagnóstico radiactivo inyectable, indicado para hombres con sospecha de metástasis o de recurrencia de cáncer de próstata. Fue aprobado para la obtención de imágenes a través de tomografías por emisión de positrones (PET) de lesiones positivas a determinado antígeno. Ver Press Release FDA. Ver Press Release Progenics.
En tanto, la norteamericana Pfizer también consiguió un OK. Fue para Myfembree, el primer tratamiento diario para el sangrado menstrual abundante asociado con fibromas uterinos. El mismo apunta a mujeres premenopáusicas y puede utilizarse hasta por 24 meses. Ver Press Release Pfizer.
El organismo aprobó además a Empaveli, para adultos con hemoglobinuria paroxística nocturna (HPN), una rara enfermedad sanguínea. Se trata de una inyección que lleva el sello de la norteamericana Apellis. Está indicada en personas que están switcheando su tratamiento con Soliris y Ultomiris, dos productos de Alexion, la firma que está siendo adquirida por AZ. Ver Press Release FDA. Ver Press Release Appelis. Ver «AstraZeneca adquiere Alexion, global».
Por otro lado, la agencia regulatoria le levantó el pulgar a Zynrelef, de la norteamericana Heron Therapeutics. De acuerdo con la compañía, es el primer anestésico local de acción dual y de liberación prolongada para el alivio del dolor postoperatorio por hasta 72 horas después de determinadas cirugías. Ver Press Release Heron.
Además se anotaron dos avales relacionados con el coronavirus. La FDA autorizó el uso de emergencia de un nuevo biológico indicado para casos de COVID-19 leves a moderados. Se trata de sotrovimab, un anticuerpo monoclonal desarrollado por la británica GSK y la norteamericana Vir Biotechnology. El mismo apunta a adultos y niños mayores de 12 años que tengan un alto riesgo de progresión a COVID-19 grave. Ver «FDA autoriza bio de GSK, COVID-19».
En paralelo, la agencia amplió la autorización de uso de emergencia para la vacuna anti COVID-19 de la norteamericana Pfizer. Ahora el OK incluye a personas de 12 a 15 años de edad. De esta forma, la vacuna de la multi se constituye en la primera en ser avalada para este rango etario. Ver Press Release Pfizer.