La ANMAT echó a rodar la disposición 1918, en la que estableció los criterios para la selección de una especialidad medicinal como producto de referencia para estudios de bioequivalencia. Ver disposición.
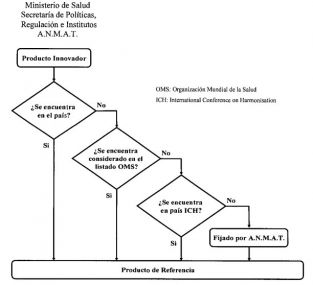
Para ello determinó los parámetros que están claramente reflejados en el «algoritmo de decisión» que forma parte de la mencionada disposición.
El primer criterio de definición será que el producto sea innovador, consumido y comercializado en el país. Si ello no sucediera, el segundo criterio es que se encuentre contemplado dentro del Informe Técnico de la OMS, N° 902, del año 2002 y posteriores.
Si ello no fuera posible, el tercer criterio es que se trate de un producto innovador consumido y proveniente de un país que forme parte de la International Conference on Harmonisation.
Por último, que sea un producto designado por la ANMAT de acuerdo a su perfil de seguridad, eficacia y/o estudio/s de comportamiento farmacocinético.