La era de la sequía de drogas parece que quedó atrás. A pesar del «shutdown» por el que la FDA está afectada durante este enero, el organismo dio a conocer el informe final en el que detalla las nuevas moléculas aprobadas durante el 2018.
La FDA publicó su clásico informe anual, en el que resume las aprobaciones de nuevas drogas otorgadas durante el 2018. Ver informe.
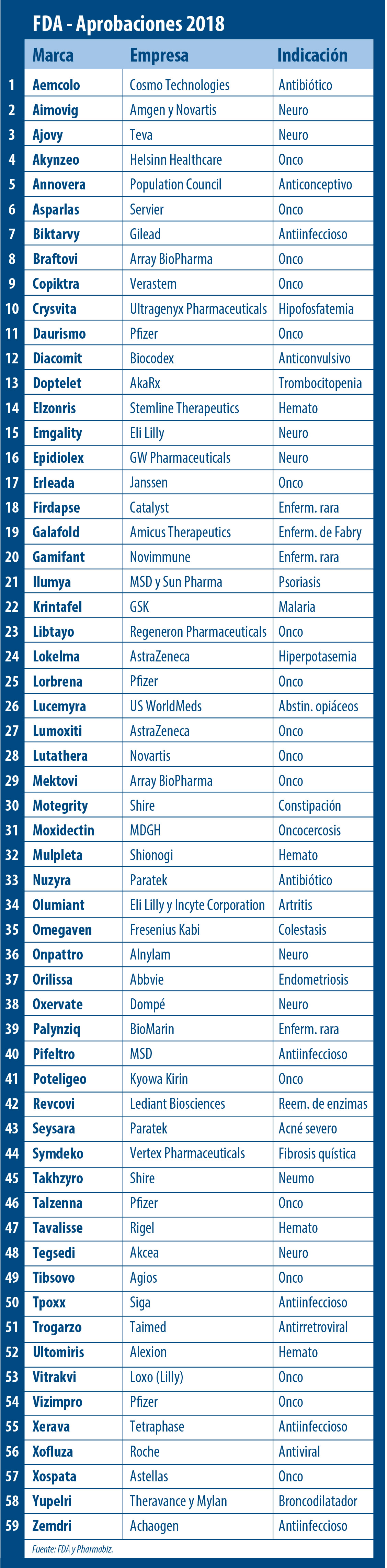
Allí consignó que fueron 59 las moléculas nóveles avaladas por el organismo en el año que cerró. Con esta cifra la agencia norteamericana batió un nuevo record siendo el 2018 el período con más aprobaciones en los últimos 10 años y superando los 46 OKs que había alcanzado en el 2017. Ver artículo.
El segmento que volvió a dar la nota fue el de Enfermedades Raras. La FDA dijo que 34 de las 59 nuevas drogas recibieron luz verde para tratar enfermedades «huérfanas». En este sentido se destacaron las aprobaciones de: Crysvita, de Ultragenyx, el primer medicamento para una forma rara y hereditaria de raquitismo; Galafold, que lleva el sello de Amicus Therapeutics, un tratamiento oral para la enfermedad de Fabry; y Palynziq, perteneciente a BioMarin, indicado para una enfermedad genética rara conocida como fenilcetonuria.
Las Enfermedades Raras picaron en punta. La agencia regulatoria dijo que 34 de los 59 avales fueron para drogas indicadas para tratar enfermedades «huérfanas». Así se destacaron las aprobaciones de Crysvita, de Ultragenyx; Galafold, de Amicus; y Palynziq, de BioMarin.
Onco y Hemato
En el 2018 la FDA respaldó a 17 oncológicos. La que se destacó en este segmento fue la norteamericana Pfizer, que recibió el visto bueno para cuatro medicamentos de este tipo: Daurismo, para leucemia mieloide aguda; Talzenna, para cáncer de mama; y Lorbrena y Vizimpro, ambos indicados para un tipo de cáncer de pulmón.
La agencia regulatoria también le dio luz verde a Erleada, de Janssen, el primer tratamiento avalado por la FDA para el cáncer de próstata no metastásico resistente a la castración; a Lumoxiti, de AstraZeneca, para leucemia de células pilosas recurrente o refractaria; y a Lutathera, de Novartis, un radiofármaco destinado a tratar cierto tipo de cáncer que afecta al páncreas o al tracto gastrointestinal, y por el que murió Steve Jobs, el fundador de Apple.
En el 2018 los oncológicos también dieron la nota. Fueron 17 los medicamentos de este tipo que recibieron el OK de la FDA. En este sentido resaltó la norteamericana Pfizer, que obtuvo el visto bueno para cuatro oncológicos: Daurismo; Talzenna; Lorbrena; y Vizimpro.
Además recibieron el OK Asparlas, que lleva el sello de Servier y que está indicado para leucemia linfoblástica aguda; Vitrakvi, de Loxo Oncology -recientemente adquirida por Eli Lilly-, para tumores sólidos localmente avanzados o metastásicos con cierta característica genética; y Xospata, de Astellas, para el tratamiento de la leucemia mieloide aguda con una mutación genética específica.
También fueron de la partida Braftovi y Mektovi, ambos pertenecientes a Array BioPharma e indicados para melanoma metastásico con cierto tipo de anomalía genética; Copiktra, de Verastem, para adultos con leucemia linfocítica crónica o con linfoma folicular; Libtayo, de Regeneron, para un tipo de cáncer de piel; Poteligeo, un biológico para dos tipos de linfoma no Hodgkin que lleva el sello de Kyowa Kirin; Tibsovo, de Agios, para leucemia mieloide aguda; y Akynzeo, de Helsinn Healthcare, para la prevención de náuseas y vómitos agudos asociados con la quimioterapia.
En la categoría de Hematología la FDA le levantó el pulgar a Elzonris, de Stemline Therapeutics, para una neoplasia hematológica poco frecuente; Mulpleta, de la japonesa Shionogi, para el tratamiento de la trombocitopenia en adultos con enfermedad hepática crónica; Tavalisse, que lleva el sello de Rigel, indicado para la trombocitopenia inmune crónica; y Ultomiris, de Alexion, para la hemoglobinuria paroxística nocturna, HPN.
Infecciosas y Neuro
En materia de enfermedades infecciosas el organismo aprobó Tpoxx, de SIGA Technologies, el primer antiviral indicado para tratar la viruela, una enfermedad que fue erradicada en los ’80 pero que según la FDA podría ser utilizada como arma biológica. Además la agencia regulatoria le dio luz verde a dos versiones de la misma droga indicadas para malaria: Krintafel, para prevenir recaídas de la enfermedad; y Arakoda, para personas que viajan a zonas endémicas, ambas pertenecientes a GSK.
También recibió el OK Trogarzo, un medicamento antirretroviral de TaiMedBiologics, que fue catalogado como una nueva clase de droga para el HIV tipo 1. Y para la misma enfermedad la FDA autorizó a Biktarvy, de Gilead; y a Pifeltro, de MSD.
El organismo le levantó el pulgar a su vez a Xofluza, de Roche, para el tratamiento de la influenza no complicada; a Aemcolo, de Cosmo Technologies, para tratar la diarrea del viajero; a Nuzyra, de Paratek, para neumonía bacteriana así como para infecciones agudas de la piel; a Xerava, que lleva el sello de Tetraphase Pharmaceuticals y que está indicado para infecciones intra-abdominales complicadas; y a Zemdri, de Achaogen, para infecciones complicadas del tracto urinario.
Contiene Flipping Book:















