El 2020 estuvo signado por la pandemia del COVID-19 y las cuarentenas que se activaron en la mayoría de los países. Sin embargo, el ritmo de aprobaciones de nuevas moléculas en los Estados Unidos no se detuvo e incluso superó al del 2019.
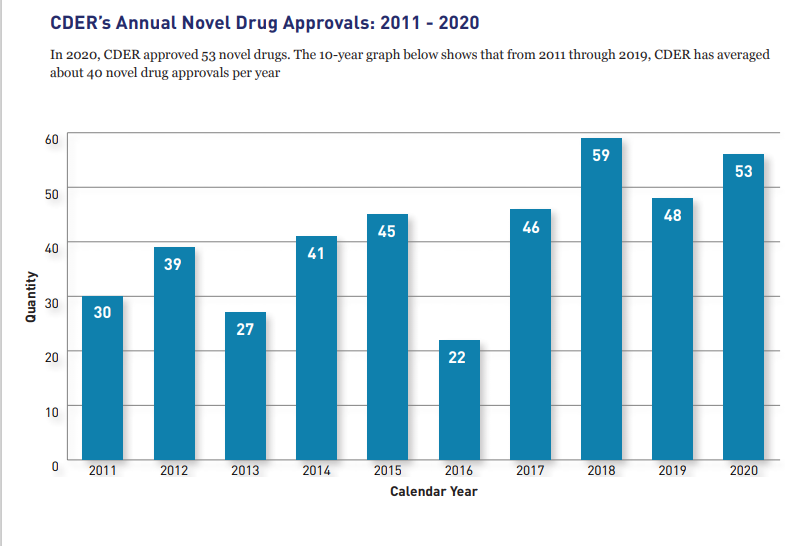
El coronavirus no fue obstáculo para que la FDA encienda la máquina de las aprobaciones. Según su propio informe anual, la agencia aprobó 53 nuevos tratamientos durante el 2020. Así estuvo por encima de los 48 avalados en el 2019. Ver Informe. Ver Documento.
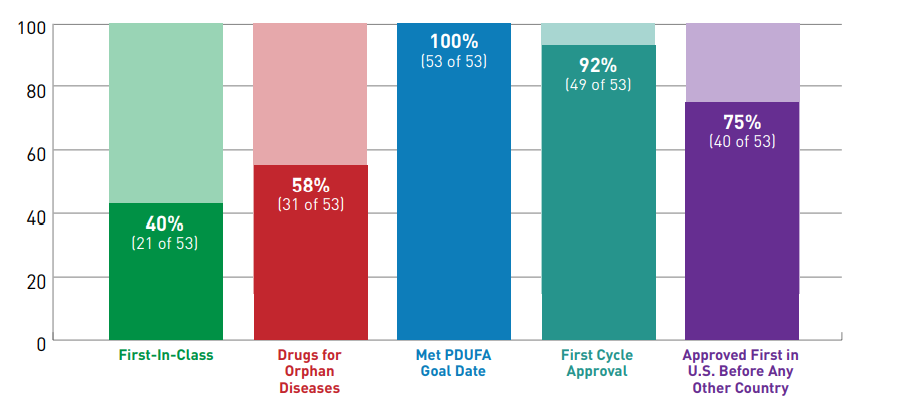
La FDA, que suele estar a la cabecera de todas las autoridades regulatorias globales, puntualizó además que 40 de las 53 drogas nóveles aprobadas durante el año pasado fueron avaladas en los Estados Unidos antes que en cualquier otro país.
Durante la última parte del 2020 la FDA también se mantuvo activa con el análisis de las vacunas anti COVID-19. Si bien algunas de ellas ya fueron aprobadas para su uso de emergencia, las mismas no integran este listado ya que forman parte del grupo de biológicos.
El organismo exhibió que las Enfermedades Raras fueron las estrellas del 2020. El 58% de los OKs otorgados por la FDA fueron para terapias enroladas en esta categoría. Entre ellas se destacó Evrysdi, de la biotecnológica Genentech -que forma parte de la suiza Roche– y de la norteamericana PTC Therapeutics. Es un medicamento para la Atrofia Muscular Espinal (AME), que en el año que cerró se subió al ring para competir directamente con el híper caro Spinraza de la norteamericana Biogen.
Roche también consiguió el visto bueno para Enspryng indicado para el trastorno del espectro de la neuromielitis óptica. Y otro biológico avalado en este grupo fue Blenrep, de la británica GSK, el que apunta a adultos con mieloma múltiple recidivante o refractario. En tanto, la suiza Novartis consiguió el OK de la FDA para Kesimpta, una terapia celular para la esclerosis múltiple, y que hace 11 años había sido aprobada originalmente para leucemia linfocítica crónica.
Otro medicamento relevante que recibió luz verde por parte de la agencia regulatoria el año pasado fue Viltepso, un inyectable a base de viltolarsen, del laboratorio norteamericano NS Pharma, subsidiario de la japonesa Nippon Shinyaku. El producto se constituyó como la segunda «terapia dirigida» para personas con distrofia muscular de Duchenne, un trastorno genético poco común.
First in Class
La FDA consigna en su informe que el 40% de los nuevos productos aprobados fueron primeros en su clase. En este grupo está incluido por caso, el antiviral Veklury, a base de remdesivir, de la farmacéutica Gilead. Fue el primer medicamento avalado en los Estados Unidos para el tratamiento de personas con COVID-19.
También se destacó Rukobia, a base de fostemsavir, de ViiV Healthcare, propiedad de GSK, de Pfizer y de Shionogi. Se trata de un nuevo tipo de antirretroviral para adultos con HIV que hubieran recibido múltiples tratamientos previos y cuya infección por HIV no se puede tratar con éxito con otras terapias debido a problemas de resistencia, u otras.
A su vez la FDA le levantó el pulgar a Koselugo -a base de selumetinib-, el primer tratamiento para la neurofibromatosis tipo 1 en niños, un desorden genético del sistema nervioso que genera el crecimiento de tumores en los nervios. El mismo lleva el sello de la británica AstraZeneca y de la norteamericana MSD, como parte de un agreement sellado en el 2017.
Oncología
El año pasado, la agencia norteamericana también le levantó el pulgar a varias terapias nuevas para uso en Oncología. ¿Lo más destacado? El organismo aprobó 11 nuevos tratamientos para cáncer de pulmón. Dos de ellos fueron para el tipo de cáncer de células pequeñas; y nueve para diversas formas de cáncer de pulmón de células no pequeñas.
Entre ellos se puede mencionar a Gavreto, de la suiza Roche; y Tabrecta, de la también suiza Novartis. Asimismo le levantó el pulgar a Retevmo de Loxo Oncology, una firma que forma parte de la norteamericana Eli Lilly; y a Zepzelca, de la española PharmaMar y la irlandesa Jazz Pharmaceuticals.
En el 2020 el organismo regulatorio también aprobó cuatro nuevas terapias notables para tratar a personas con diversos tipos de cáncer de mama. Fueron Phesgo, de la biotecnológica Genentech; Trodelvy, de Immunomedics; Tukysa, que lleva el sello de Seattle Generics; y Margenza, un biológico desarrollado por la norteamericana MacroGenics.
Aprobaciones y criterios
FDA: casi 50 nuevas moléculas (2019).

La FDA aprobó 53 nuevos medicamentos en 2020. Mirá el informe. #FDA #Aprobaciones #Medicamentos #Pandemia #COVID-19 #Farma #Pharmabiz