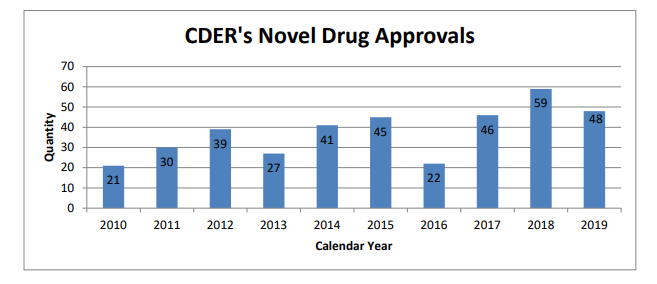
En el 2019 la FDA aprobó menos drogas nóveles que en el 2018. Sin embargo, la cantidad de avales se convirtió en la segunda más alta de la última década al alcanzar las 48 nuevas moléculas.
La FDA aprobó 48 nuevas drogas durante el 2019, según lo dio a conocer ayer. A través de su Centro de Evaluación e Investigación de Drogas -CDER-, detalló que 20 de las mismas (42%) son primeras en su clase y tienen a menudo mecanismos de acción diferentes en relación a las terapias existentes.
La cantidad de aprobaciones alcanzada por la agencia regulatoria en este período resultó menor que la del año anterior, cuando la FDA le levantó el pulgar a 59 moléculas. Sin embargo se convirtió en la segunda cifra más alta de la última década. Ver artículo.
El organismo regulatorio se jacta de haber respaldado una gran cantidad de tratamientos antes que otros países. Se consignó que 33 de las 48 nuevas drogas del 2019 (69%) fueron autorizadas previo a otras agencias pares.
Entre las drogas nóveles respaldadas en 2019 figura el biológico Adakveo, de la suiza Novartis, indicado para reducir la frecuencia de las crisis vasooclusivas. También resaltó el aval del oncológico Turalio desarrollado por la japonesa Daiichi-Sankyo; y el de Ibsrela de la norteamericana Ardelyx, que apunta a tratar el síndrome de intestino irritable con constipación. Además sobresalió Reyvow de la norteamericana Eli Lilly, para la migraña. Ver informe.
En paralelo, 21 de las nuevas aprobaciones fueron concedidas para tratar enfermedades huérfanas. Dentro de este segmento, se hicieron notar el oncológico Brukinsa de la china BeiGene, para linfoma de células del manto; y Trikafta para fibrosis quística, que lleva el sello de la norteamericana Vertex Pharmaceuticals. Asimismo resaltaron Oxbryta apuntado a tratar la anemia falciforme y perteneciente a la norteamericana Global Blood Therapeutics; y el biológico Polivy desarrollado por la suiza Roche para personas con linfoma no Hodgkin.
A su vez, la FDA destacó los avales que otorgó antes que los organismos pares de otros países. En su informe consignó que 33 de las 48 nuevas drogas autorizadas a lo largo de 2019, es decir un 69%, recibieron luz verde en Estados Unidos previo a obtenerla por parte de otras agencias regulatorias.
Tal fue el caso de Beovu de la suiza Novartis, indicado para la degeneración macular; Fetroja de la japonesa Shionogi, para infecciones del tracto urinario; Vyondys 53 que apunta a tratar la distrofia muscular y que pertenece a Sarepta Therapeutics; y Sonusi para la somnolencia diurna y que lleva el sello de la irlandesa Jazz Pharmaceuticals.
Cabe resaltar además que la FDA consigna por separado las aprobaciones de productos sanguíneos, terapias génicas y celulares. En dicho segmento la aprobación clave en este 2019 fue la de Zolgensma, la terapia génica de Novartis que le dará pelea a Spinraza el medicamento de ultra alto costo de Biogen para atrofia muscular espinal.