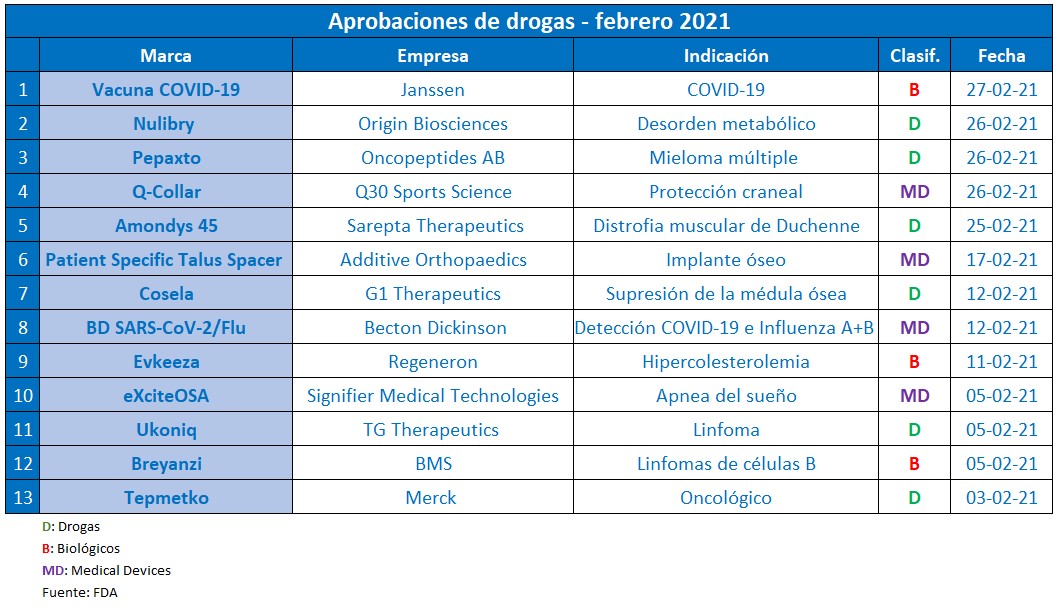
En el mes más corto del año, la agencia regulatoria norteamericana le dio luz verde a una variada serie de productos. La estrella del mes fue la autorización de la vacuna contra el COVID-19 de la norteamericana Janssen.
Este febrero del 2021 llegó a su fin con una agenda marcada por la pandemia del coronavirus. Sin embargo, la FDA permaneció súper activa con aprobaciones extra COVID-19. Por ello el equipo de Pharmabiz publica un nuevo reporte mensual que resume los principales productos avalados.
Sin dudas, la novedad más importante de este período fue la autorización de la vacuna de Janssen contra el COVID-19. El producto, que en la Argentina ya inició estudios clínicos, fue autorizado para uso de emergencia en Estados Unidos. De esta forma, se constituyó como la tercera vacuna aprobada después de la de Pfizer -el 2 de diciembre del año pasado- y la de Moderna -el 8 de enero de 2021. Ver artículo.
Además, el segmento de Onco fue el gran protagonista de la temporada. Se llevaron el OK Tepmetko, de Merck; Breyanzi, de BMS; Ukoniq, de TG Therapeutics; Amondys 45, de Sarepta Therapeutics; y dos nuevas indicaciones para Libtayo, de Sanofi y Regeneron.
Por fuera del coronavirus, en el segundo mes del año la nota la dio el segmento de Onco. Por caso, uno de los que obtuvo el visto bueno fue Tepmetko, de la alemana Merck. El mismo está indicado para cáncer de pulmón no microcítico (CPNM) metastásico, con alteraciones por omisión del exón 14 en el gen MET. Ver Press Release.
La FDA también le otorgó el OK a Breyanzi, de la estadounidense BMS: una terapia génica para linfoma de células B grandes. Y en paralelo la agencia avaló a Ukoniq, que lleva el sello de la norteamericana TG Therapeutics: un inhibidor de la quinasa, indicado para adultos con linfoma folicular o de zona marginal. Ver artículo Breyanzi. Ver Press Release Ukoniq.
El organismo regulatorio también respaldó dos nuevas indicaciones para Libtayo, que lleva la firma de la francesa Sanofi y de la norteamericana Regeneron. La inmunoterapia, que había sido autorizada en el 2018 para carcinoma cutáneo de células escamosas, ahora consiguió el OK para carcinoma de células basales avanzado y para el tratamiento de primera línea del cáncer de pulmón de células no pequeñas. Ver artículo. Ver Press Release.
Además, la FDA le dio el visto bueno a la primera droga conjugada de péptidos contra el cáncer para personas con mieloma múltiple recurrente o refractario. Se trata de Pepaxto de la sueca Oncopeptides Ab. A su vez , se llevó el sí Cosela, de la norteamericana G1 Therapeutics. Se trata de la primera terapia aprobada para reducir la frecuencia de la supresión de la médula ósea inducida por la quimioterapia. Ver Press Release. Ver Press Release.
Por otra parte, en este febrero de 2021 recibió la venia el biológico Evkeeza, que lleva el sello de Regeneron. Este inyectable se consolida como un tratamiento complementario para la HoFH –hipercolesterolemia familiar homocigota-, una afección genética que genera niveles elevados de colesterol. Ver Press Release.
Sarepta Therapeutics también obtuvo el visto bueno por parte de la FDA. En esta oportunidad fue para Amondys 45: un inyectable indicado para la distrofia muscular de Duchenne, que se constituye como el primer tratamiento para este trastorno genético caracterizado por debilidad y deterioro progresivo de los músculos. Ver Press Release.
La agencia regulatoria a su vez le levantó el pulgar a Nulibry de la norteamericana Origin Biosciences, el que apunta a reducir el riesgo de muerte debido a la deficiencia de cofactor de molibdeno tipo A. Se trata de un trastorno metabólico genético poco común que generalmente se presenta en los primeros días de vida y causa convulsiones intratables, lesiones cerebrales o muerte. Ver Press Release.
En la categoría de medical devices, la FDA le dio luz verde a eXciteOSA, de la norteamericana Signifier Medical Technologies. Es el primer dispositivo que apunta a reducir los ronquidos y la apnea obstructiva del sueño leve, y que no se utiliza al dormir. Ver Press Release.
Asimismo, la agencia le otorgó el OK a Patient Specific Talus Spacer, un implante óseo impreso en 3D para el reemplazo del astrágalo, un hueso de la articulación del tobillo, en casos de necrosis avascular. El mismo pertenece a la norteamericana Additive Orthopaedics. Ver Press Release.
Y en estos tiempos de pandemia, los devices de diagnóstico no quedaron fuera de la lupa de la FDA. Becton Dickinson obtuvo el aval para otro test de diagnóstico para identificar el COVID-19, el que tiene la particularidad de detectar también la influenza A y B. Ver artículo.
Otro que recibió la venia fue el collar para deportistas bautizado Q-Collar de la empresa Q30 Sports Science. Es un device no invasivo que aumenta el volumen de sangre para ayudar a proteger el cerebro de los efectos de los impactos repetitivos al realizar actividades deportivas. Ver artículo.