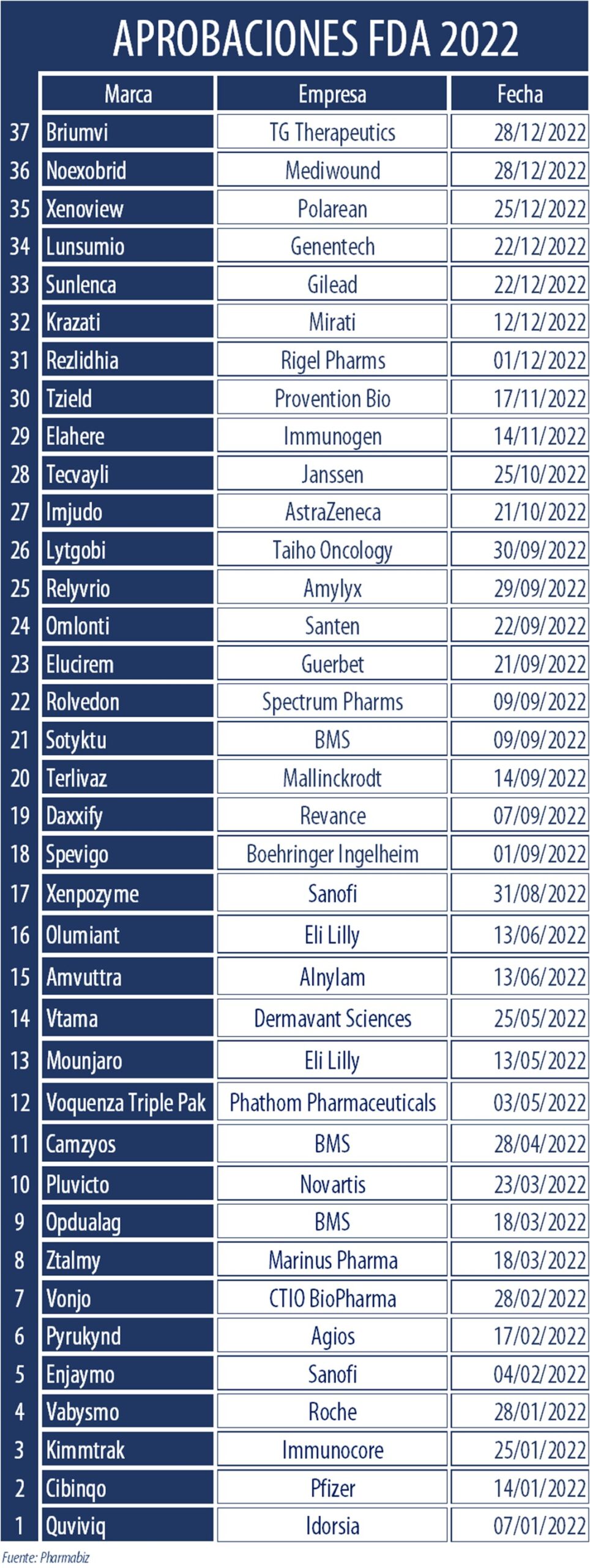
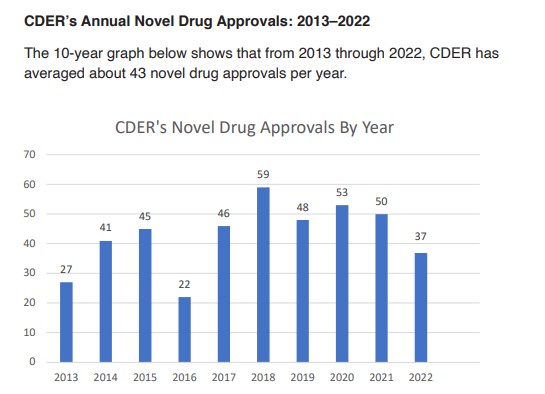
La FDA puso en línea su tradicional informe en el que pasa revista a las aprobaciones del año. En el 2022, el organismo le dio luz verde a 37 nuevos productos, una cifra que se ubica por debajo del promedio de la última década e incluso de lo avalado en el primer bienio de pandemia.
Tras dar vuelta el calendario, el organismo regulatorio norteamericano dio a conocer su tradicional informe, en el que da cuenta de su actividad a lo largo del año. Ver Documento
De acuerdo con el documento, la agencia aprobó 37 nuevos productos en este período. El dato: el número de aprobaciones estuvo muy por debajo del promedio de la última década, que se ubica en 43. Más aún, la diferencia fue notoria respecto del 2021 y el 2020, los dos años más críticos de la pandemia de COVID-19, en los que los avales fueron 50 y 53, respectivamente.
De todos modos y a pesar de esta desaceleración, la FDA sigue marcando la señal de largada frente a todas las demás autoridades regulatorias del mundo. Tal es así que precisó que 25 de las 37 drogas nóveles aprobadas durante el 2022 (68%) no habían recibido hasta entonces el aval en ningún otro mercado.
Según el documento, la nómina de avales incluyó productos para un amplio abanico de enfermedades, lo que incluye infecciosas, como el COVID-19, el HIV y la viruela; neurológicas, como la esclerosis lateral amiotrófica y espinal; cardíacas, sanguíneas, renales y endocrinas, como la diabetes tipo 1 y 2; autoinmunes, inflamatorias y pulmonares, como la nefritis lúpica y la artritis; y así como diferentes tipos de cáncer.
A su vez, y al igual que en el 2021, la FDA le dedicó gran atención a las enfermedades raras. En concreto, este segmento se llevó 20 de los 37 avales. Entre ellos se listan los inyectables Amvuttra, de la norteamericana Alnylam, para la polineuropatía en adultos con amiloidosis mediada por transtiretina hereditaria; Elahere, de la estadounidense ImmunoGen, para cáncer de ovario recurrente y resistente a la terapia con platino; Enjaymo, de la francesa Sanofi, para disminuir la necesidad de transfusiones de glóbulos rojos debido a la hemólisis en adultos con aglutininas frías; e Imjudo, de la británica AstraZeneca, para carcinoma hepatocelular irresecable.
First in Class
El regulador estadounidense precisó en su informe que 20 de los 37 nuevos productos (54%) aprobados fueron primeros en su clase. En este grupo están incluidos Mounjaro, de la norteamericana Eli Lilly, para diabetes tipo 2; Pluvicto de la suiza Novartis, para cáncer de próstata; y Voquezna Triple Pak, de la norteamericana Phathom Pharmaceuticals, para infecciones por Helicobacter Pylori.
El listado se completa con Camzyos, de estadounidense BMS; Elahere, de la estadounidense ImmunoGen; Enjaymo, de la francesa Sanofi; Kimmtrak, de la británica Immunocore; Lunsumio, de la suiza Roche; Opdualag, de la estadounidense BMS; Pyrukynd, de a norteamericana Agios; Sotyktu, de BMS; Spevigo, de la alemana Boehringer Ingelheim; Sunlenca, de la estadounidense Gilead; Tecvayli, de la estadounidense Janssen; Terlivaz, de la estadounidense Mallinckrodt; Tzield, de la estadounidense Provention Bio; Vtama, de la norteamericana Dermavant Sciences; Xenoview, de la norteamericana Polarean; Xenpozyme, de Sanofi; y Ztalmy, de la estadounidense Marinus Pharma.
Otros highlights del 2022
La FDA destacó un dúo de productos aprobados en este período. Se trata de las tabletas de Cibinqo, bajo el sello de la norteamericana Pfizer, indicadas para dermatitis atópica moderada a severa; y de la crema Vtama, propiedad de la biofarmacéutica Dermavant Sciences, para psoriasis en placas.
Asimismo, precisó que, en el 2022, el Centro de Evaluación e Investigación de Medicamentos, CDER, le dio el OK a siete nuevos biosimilares. Y uno de ellos fue catalogado como intercambiable, es decir, que puede sustituirse por el producto de referencia sin la intervención de un prescriptor. Se trata de Cimerli, un inhibidor del factor de crecimiento endotelial vascular, de la estadounidense Coherus, y el primer intercambiable de Lucentis, de la suiza Novartis. A su vez, fue recategorizado bajo el rótulo de intercambiable Udenyca, también de Coherus. El mismo había sido aprobado inicialmente en el 2018, para el síndrome de radiación aguda, y tomó como referencia a Neupogen, da Amgen.
Informe de aprobaciones de FDA del 2021