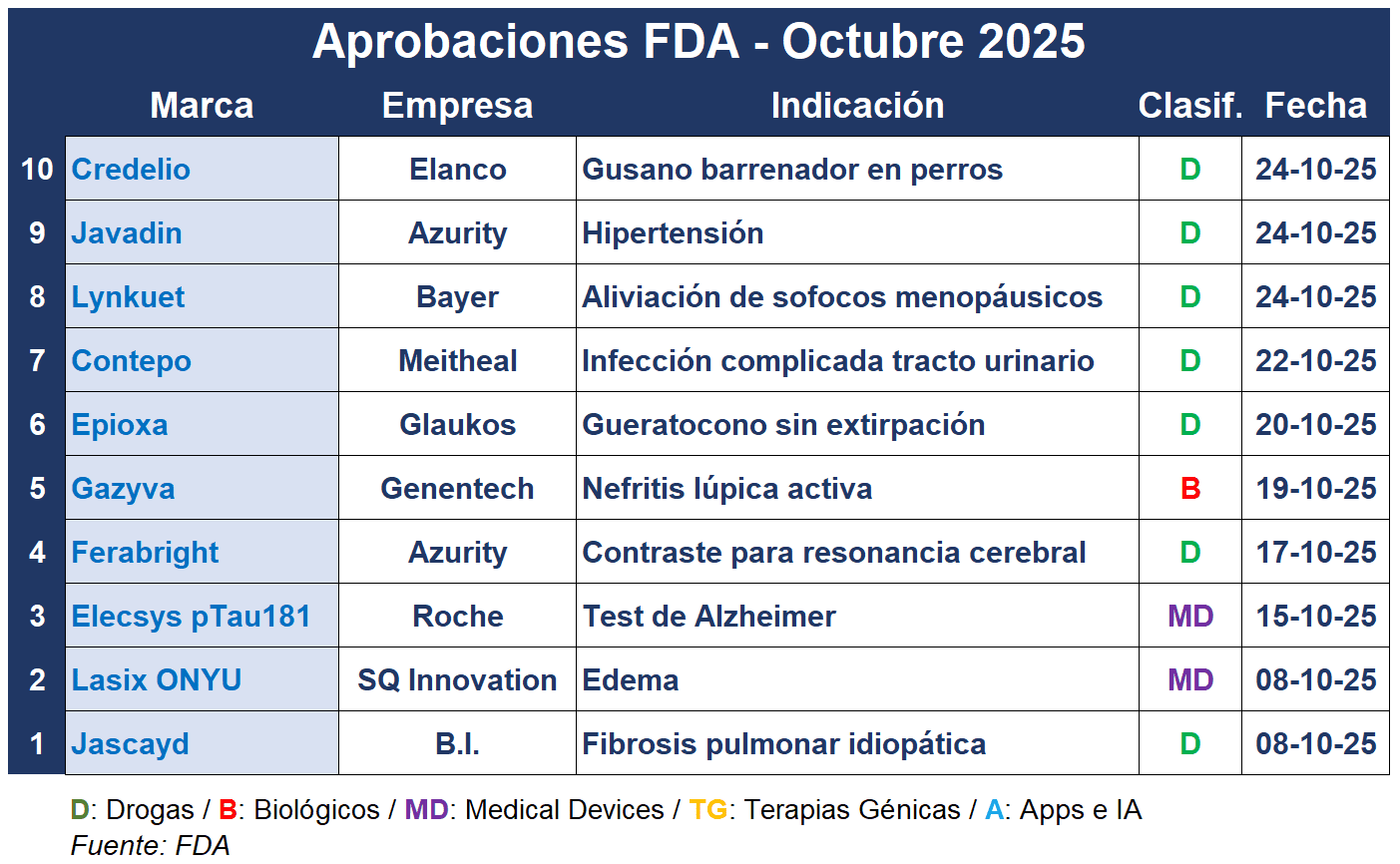
Con el cierre de octubre toca repasar la lista de aprobaciones que la FDA otorgó este mes. La agencia le dio el sí a un producto para la fibrosis pulmonar rara, la nefritis lúpica, un test que detecta el Alzheimer, y más.
Terminó el décimo mes del año, el que deja una lista de aprobaciones novedosas para variadas indicaciones. Además y como ya es usual este año, desde el organismo se siguen anunciando nuevas medidas con las que se apunta a bajar los costos de producción y facilitar el acceso de los biosimilares. Ver FDA: medidas biosimilares
En octubre, la alemana Boehringer Ingelheim reforzó su liderazgo en el campo de las enfermedades pulmonares raras con la primera nueva opción de tratamiento para la fibrosis pulmonar idiopática en más de una década. Se trata de Jascayd, un medicamento oral que sigue a Ofev, de BI, y Esbriet, de Roche. Ver FDA: OK para Jascayd de B.I.
La FDA también avaló Elecsys pTau181 como el primer test de sangre para descartar la enfermedad de Alzheimer en el entorno de la atención primaria. El producto, desarrollado por la suiza Roche con Eli Lilly está indicado para el uso en pacientes mayores de 55 años con trastornos o síntomas cognitivos. Ver FDA: OK para test
Y la alemana Bayer finalmente recibió la luz verde de la FDA para su nuevo producto para la menopausia después de una extensión de tres meses en su revisión. Lynkuet, presentado como una cápsula blanda bajo dosis diaria, está indicado para aliviar los síntomas vasomotores de moderados a graves, comúnmente conocidos como sofocos. Ver FDA: luz verde para Lynkuet
Además Genentech, la subsidiaria de la suiza Roche, recibió el visto bueno para Gazyva, un anticuerpo monoclonal indicado para la nefritis lúpica activa en personas que reciben la terapia standard. La FDA le había otorgado a Gazyva la designación de Terapia Innovadora en el 2019. Ver Press Release
También en octubre, la FDA aprobó una nueva terapia ocular de la especialista Glaukos Corp. A base de una formulación de riboflavina y la administración de luz UV-A, Epioxa ofrece una opción menos dolorosa para tratar el queratocono, una afección progresiva que puede afectar gravemente la visión. Ver FDA: luz verde para Epioxa
Azurity Pharmaceuticals recibió dos avales de la FDA en octubre. Por un lado, el regulador aprobó Javadin, una formulación líquida de clonidina de liberación inmediata para uso oral en el tratamiento de la hipertensión en pacientes adultos. A su vez, la empresa de Woburn, Massachusetts, recibió la luz verde para Ferabright como el primer agente de contraste a base de hierro indicado para la resonancia magnética cerebral. Ver Release Javadin // Ver Release Ferabright
SQ Innovation, recibió el OK de la FDA para su combinación de fármaco y dispositivo Lasix ONYU. A base de la furosemida inyectable, el producto está indicado para el tratamiento del edema debido a la sobrecarga de líquidos en pacientes adultos con insuficiencia cardíaca crónica. Permite la infusión subcutánea de furosemida fuera del entorno hospitalario sin necesidad de que un profesional sanitario administre el medicamento. Ver Press Release
Meitheal Pharmaceuticals, de Chicago, recibió la autorización de la FDA para el antibiótico epóxido Contepo. El inyectable a base de fosfomicina está indicado para el tratamiento de adultos con infecciones complicadas del tracto urinario, ITUc, incluyendo pielonefritis aguda, causadas por cepas susceptibles de Escherichia coli y Klebsiella pneumoniae. Ver carta de la FDA
En cuanto a productos veterinarios, la FDA emitió su primera Autorización de Uso de Emergencia en este campo. Credelio de Elanco, que fue aprobado por primera vez en el 2018 para indicaciones relacionadas a pulgas y garrapatas, ahora se puede usar para tratar las infestaciones del gusano barrenador del nuevo mundo en perros. En sintonía, el mes pasado, el regulador había aprobado Dectomax-CA1 de Zoetis como el primer producto para la prevención y el tratamiento de esta plaga en el ganado. Ver Press Release