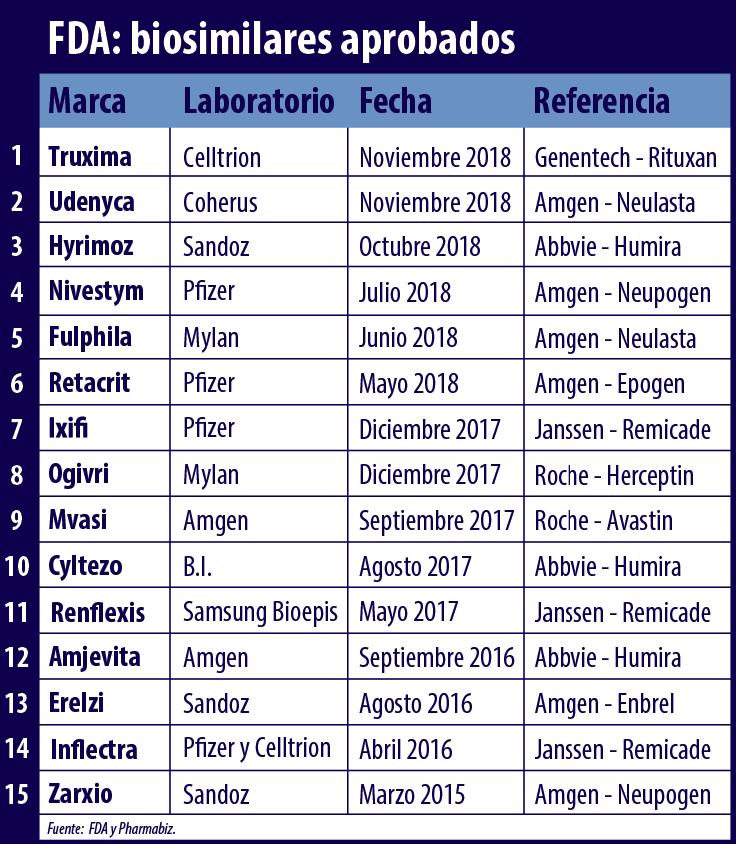
La FDA le dio luz verde a Truxima, un producto de la coreana Celltrion. Se trata del primer bioequivalente de Rituxan, de la suiza Roche. Así, la agencia ya suma 15 biosimilares avalados al momento.
La FDA aprobó su decimoquinto biosimilar y el primero del oncológico Rituxan, un producto que pertenece a Genentech, del grupo suizo Roche. Ver Press Release.
Se trata de Truxima de la coreana Celltrion que recibió el OK para el tratamiento del linfoma no Hodgkin, y que puede utilizarse como agente único o en combinación con quimioterapia.
El medicamento, que ya estaba autorizado en Europa, le dará pelea a Rituxan -que en Argentina se comercializa bajo la marca MabThera– un producto top de Roche que, según Reuters, le otorga ventas anuales por u$s 7.000 millones. Ver artículo.
La aprobación de Truxima forma parte de un plan de la FDA que apunta a que el desarrollo de los biosimilares sea más eficiente, a promover la competencia y a ampliar el acceso a medicamentos claves. A principios de noviembre el organismo ya le había dado luz verde a Udenyca, de Coherus BioSciences, un bioequivalente de Neulasta, de la norteamericana Amgen. Ver artículo.