Las aprobaciones extra COVID-19 continúan en la agenda de la FDA en este 2021 de pandemia. En el cuarto mes del año, la agencia regulatoria norteamericana le levantó el pulgar a nuevas moléculas y medical devices, así como a segundas indicaciones.
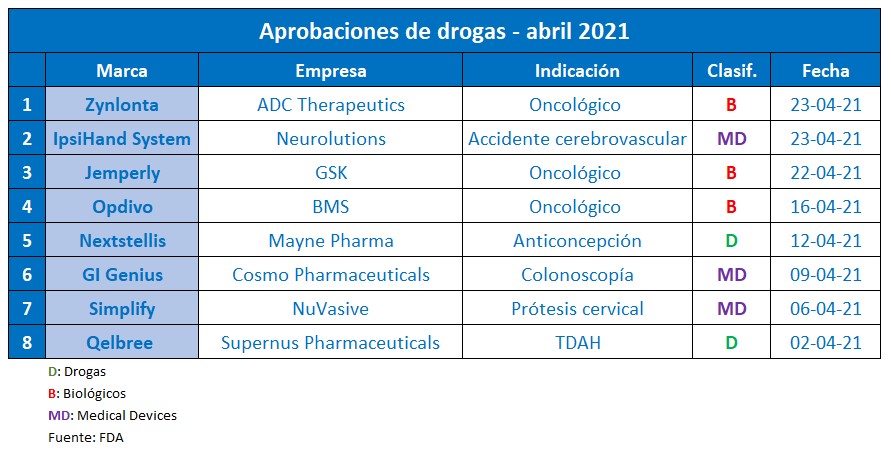
Pese al contexto marcado por la pandemia del COVID-19, durante abril la FDA siguió activa en materia de aprobación de nuevas moléculas. En el mes que cerró, se destacaron al menos ocho novedades que recibieron luz verde por parte del organismo regulatorio.
Por caso, el segmento de Onco continúa anotando news. La agencia le dio el OK al biológico Jemperli, de la británica GSK. Esta inmunoterapia está indicada para el cáncer de endometrio avanzado o recurrente, con una característica genética específica conocida como dMMR. El producto apunta a personas cuya enfermedad ha progresado durante o después de un tratamiento con quimioterapia basada en compuestos de platino. Ver artículo. Ver Press Release.
Además, el organismo respaldó una nueva indicación para Opdivo de la norteamericana BMS. Es un biológico que había conseguido el visto bueno de la FDA en el 2015 y de la ANMAT en el 2016, para cáncer de pulmón. Ahora el producto obtuvo luz verde en combinación con ciertos tipos de quimioterapia para el tratamiento inicial del cáncer gástrico, cáncer de la unión gastroesofágica y adenocarcinoma de esófago. Ver Press Release FDA. Ver artículo 2016.
La suiza ADC Therapeutics también se llevó una aprobación por parte de la FDA. En esta oportunidad fue para Zynlonta, un anticuerpo dirigido que apunta a adultos con linfoma de células B grandes, en recaída o refractario, que hayan recibido dos o más líneas de terapia sistémica. Ver Press Release.
Por otro lado, la agencia avaló a Qelbree de la norteamericana Supernus Pharmaceuticals. El medicamento fue desarrollado para el trastorno por déficit de atención con hiperactividad -TDAH-, en personas de 6 a 17 años. El mismo se constituye como el primer tratamiento no estimulante aprobado para esta condición en la última década. Ver Press Release.
En materia de anticoncepción oral, el organismo norteamericano le levantó el pulgar a Nextstellis de la australiana Mayne Pharma. Se trata de la primera píldora en base a un estrógeno que se genera naturalmente durante el embarazo, pero que ahora es producido a partir de una fuente vegetal. Ver Press Release.
En el apartado de devices, la FDA le dio el visto bueno a GI Genius de la italiana Cosmo Pharmaceuticals. Es el primer dispositivo que utiliza inteligencia artificial basada en el aprendizaje automático a fin de facilitar la detección de lesiones en el colon, como pólipos o tumores sospechosos, en tiempo real durante una colonoscopía. Ver Press Release.
Otro que recibió la venia fue Simplify de la norteamericana NuVasive. Es un implante que apunta a reemplazar uno o dos discos adyacentes entre las vértebras del cuello. El mismo está conformado por dos placas terminales de plástico y un núcleo de cerámica, y su uso fue avalado en personas adultas. Ver Press Release.
A la lista de aprobaciones de devices se sumó también Neurolutions IpsiHand, un dispositivo de interfaz cerebro-computadora, para la rehabilitación de personas que luego de un accidente cerebrovascular tengan discapacidad en las extremidades superiores. El mismo lleva el sello de la norteamericana Neurolutions, especializada en soluciones de neuro-rehabilitación que utilizan la propia actividad cerebral para facilitar la recuperación motora. Ver Press Release.