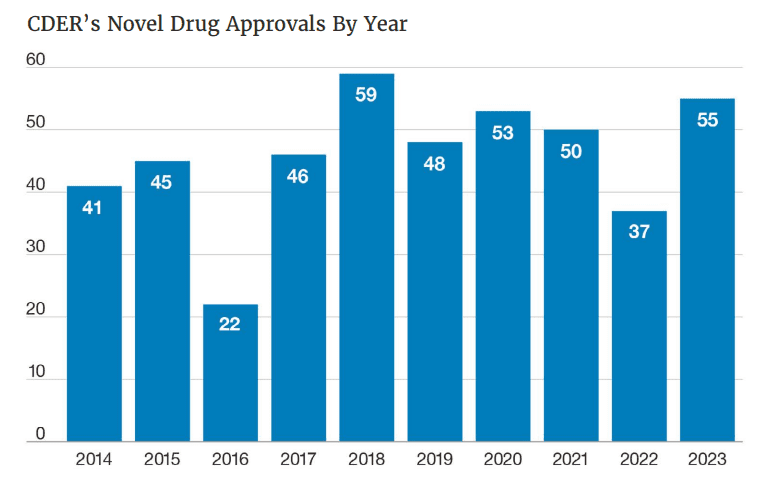
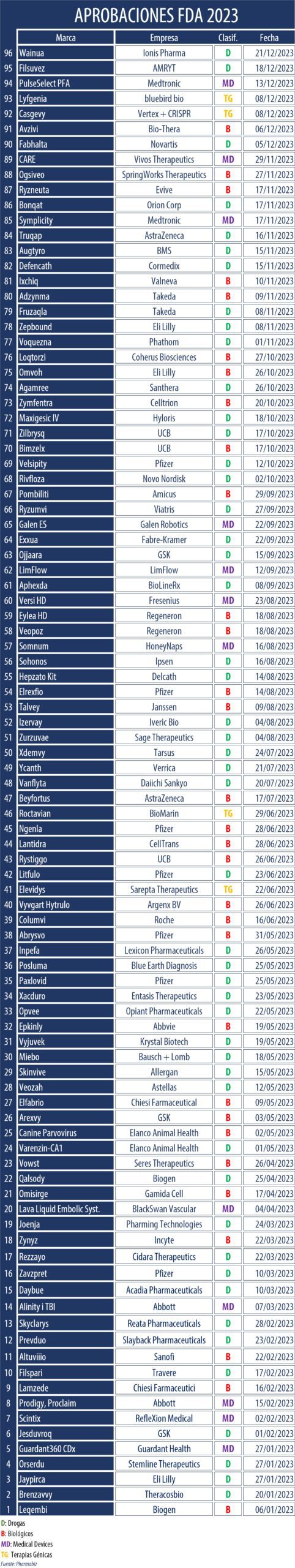
La FDA hizo púbico hoy su tradicional informe en el que repasa las aprobaciones del 2023. Allí se compilan las 55 nuevas moléculas que el organismo avaló durante el 2023. Se trató de un año en el que sus aprobaciones picaron en punta, y en el que se superó y por mucho las 37 aprobaciones del año 2022.
Las aprobaciones de la FDA siempre se constituyeron como un faro para el resto de sus organismos pares, los que toman como referencia todas sus decisiones respecto de la aprobación de nuevos productos. En ese contexto, resulta relevante pasar revista a cada una de las aprobaciones del organismo durante el 2023, las que fueron compiladas hoy en un informe especial. Ver Documento
De acuerdo con el documento, la FDA fue super prolífica durante el 2023. La agencia le dio el visto bueno a 55 moléculas nóveles durante el año pasado. Así generó un 48.6% más de avales respecto del 2022, cuando surgieron 37 productos aprobados. Es así que la agencia regulatoria recuperó e incluso superó el ritmo que llevaba en el 2021 y el 2020, los dos años más críticos de la pandemia de COVID-19, en los que los avales fueron 50 y 53, respectivamente. Informe FDA del 2022
En su informe, se precisó asimismo, que 35 de las 55 moléculas nóveles aprobadas durante el 2023, es decir un 64% del total fueron avaladas en Estados Unidos, antes que en ningún otro país.
Según el documento, la nómina de avales incluyó productos para un amplio abanico de enfermedades, lo que incluye infecciosas, como el COVID-19, y el virus sincitial respiratorio; indicadas en neurología; para enfermedades cardíacas, sanguíneas, renales y endocrinas, como la diabetes tipo 1 y 2. Otras de uso en enfermedades pulmonares, tales como el asma y la fibrosis cística. Y por último para varias condiciones gastrointestinales, tales como la enfermedad inflamatoria intestinal y el estreñimiento funcional pediátrico.
A su vez, y al igual que en el 2022, la FDA le dedicó gran atención a las enfermedades raras. En concreto, este segmento se llevó 28 de los 55 avales. Entre ellos se listan Agamree, de Santhera; Aphexda, de BioLineRx; Augtyro, de BMS; Daybue, de Acadia Pharmaceuticals; Elrexfio, de Pfizer; Fabhalta, de Novartis; Filspari, de Travere; Filsuvez, de AMRYT; y Jaypirca, de Eli Lilly;
También surgieron Joenja, de Pharming Technologies; Lamzede, de Chiesi Farmaceutic; Loqtorzi, de Coherus Biosciences; Ngenla, de Pfizer; Ogsiveo, de SpringWorks Therapeutics; Ojjaara, de GSK; Pombiliti, de Amicus; Qalsody, de Biogen; Rezzayo, de Melinta Therapeutics; y Rivfloza, de Novo Nordisk.
Se mencionan además a Rystiggo, de UCB; Skyclarys, de Reata Pharmaceuticals; Sohonos, de Ipsen; Talvey, de Janssen; Vanflyta, de Daiichi Sankyo; Veopoz, de Regeneron; Wainua, de Ionis Pharma; Zilbrysq, de UCB; y Zynyz, de Incyte.
First in Class
El regulador estadounidense precisó en su informe que 20 de los 55 nuevos productos aprobados, es decir un 36%, del total resultaron ser primeros en su clase.
En este grupo se incluyó a Daybue, de Acadia Pharmaceuticals; Defencath, de Cormedix; Fabhalta, de Novartis; Filspari, de Travere; Filsuvez, de AMRYT; Jesduvroq, de GSK; Joenja, de Pharming Technologies; Lamzede, de Chiesi Farmaceutici; y Miebo, de Bausch + Lomb; así como Ogsiveo, SpringWorks Therapeutics.
También a Paxlovid, de Pfizer; Qalsody, de Biogen; Rivfloza, de Novo Nordisk; Skyclarys, de Reata Pharmaceuticals; Sohonos, de Ipsen; Talvey, de Janssen; Truqap, de AstraZeneca; Veopoz, de Regeneron; Veozah, de Astellas; y Xdemvy, de Tarsus.
Otros highlights del 2023
La FDA precisó que, en el 2023, el Centro de Evaluación e Investigación de Medicamentos, CDER, le dio el OK a cinco nuevos biosimilares para cinco productos de referencia, incluidos tres productos de referencia que no tenían un biosimilar correspondiente. Se explica que varios medicamentos fueron aprobados como biosimilares intercambiables, los que son biosimilares que pueden sustituirse por el producto de referencia en la farmacia.
Los biosimilares aprobados por la FDA en el 2023 fueron Avzivi, de Bio-Thera; Tofidence, de Biogen; Tyruko, de Sandoz; Wezlana, de Amgen; y Yuflyma, de Celltrion.