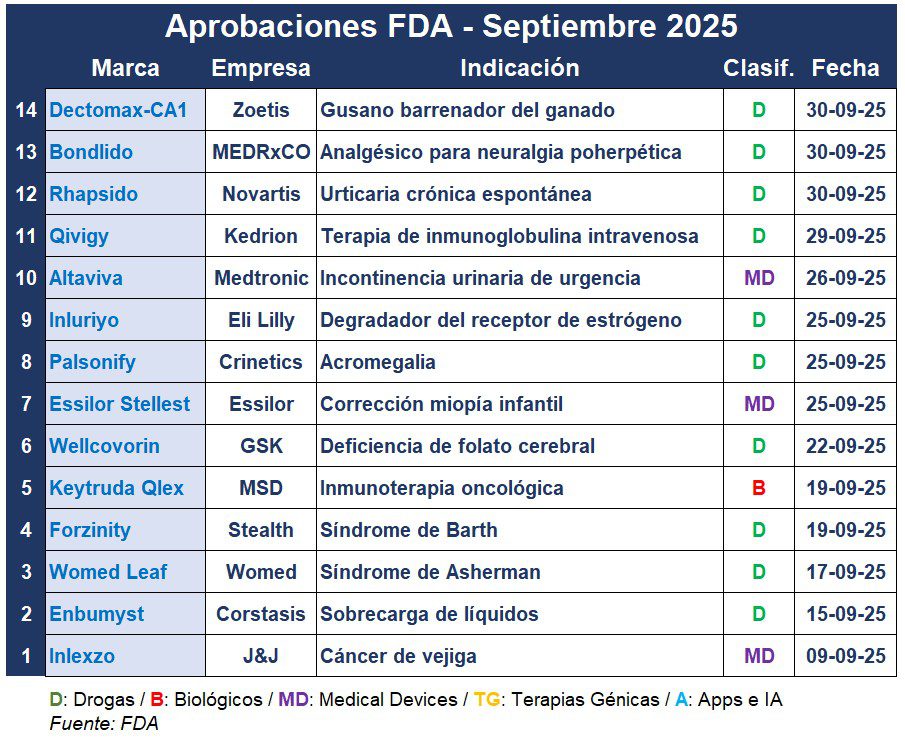
Septiembre trajo más de una decena de aprobaciones relevantes por parte de la FDA. La agencia norteamericana le dio el OK a novedosos oncológicos, tratamientos para enfermedades ultra raras, y dispositivos médicos.
El noveno mes del año terminó con numerosas autorizaciones por parte de la FDA. En sintonía, el equipo de Trump agiliza los procesos para la aprobación de tratamientos de enfermedades raras, presiona a las farmacéuticas para regular sus campañas publicitarias, y difunde desinformación sobre los efectos del Tylenol en el embarazo. Ver FDA: avalancha de warnings | FDA: nueva iniciativa para enfermedades raras
Según el relevamiento que cada mes realiza Pharmabiz, surge que la norteamericana Janssen recibió el aval de la FDA para su dispositivo Inlexzo, un nuevo método de administración del fármaco de quimioterapia, gemcitabina, para el cáncer de vejiga. El producto ofrece una posible alternativa a la extirpación quirúrgica del órgano. Ver FDA: OK para Inlexzo de J&J
Y la norteamericana MSD logró un hito importante en su estrategia en pos de defender el mercado de su blockbuster Keytruda frente el vencimiento de su patente en el 2028. Esto es porque la FDA aprobó la versión inyectable Keytruda Qlex, la que se puede administrar en tan solo dos minutos, dependiendo de la dosis. En comparación, la infusión intravenosa suele tardar unos 30 minutos. Ver FDA: luz verde para Keytruda inyectable
Además, la FDA avaló una nueva versión de Bumex, el que se administra como aerosol nasal. Bautizado Enbumyst, bajo la estadounidense Corstasis Therapeutics, está indicado para aliviar el edema asociado con la insuficiencia cardíaca congestiva, ICC, la enfermedad renal crónica, ERC, y la enfermedad hepática. Ver FDA: OK para Enbumyst de Corstasis Therapeutics
También en septiembre, la FDA le dio luz verde a la comercialización del primer dispositivo médico para el tratamiento de mujeres con síndrome de Asherman. Womed Leaf, de la francesa Womed es una barrera antiadherencias reabsorbible diseñado para pacientes que se someten a cirugía histeroscópica. Ver FDA: luz verde para Womed Leaf
Y tras un proceso turbulento lleno de retrasos y rechazos, la agencia le dio el OK al tratamiento de la norteamericana Stealth BioTherapeutics para el síndrome de Barth, una enfermedad genérica ultra rara. Forzinity se convierte en la primera terapia para esta afección, que debilita el corazón y otros músculos. Ver FDA: OK para Forzinity
Avanzando en el mes, la francesa Essilor consiguió el aval para las lentes para gafas Essilor Stellest para corregir la miopía, y retrasar la progresión de la enfermedad en pacientes de seis a 12 años al inicio del tratamiento. La decisión supone una ampliación de las opciones de tratamiento para pacientes pediátricos, en particular para aquellos que no pueden o no desean usar lentes de contacto. Ver artículo Essilor
Por otra parte, el aval menos usual del noveno mes fue la decisión de autorizar Wellcovorin, un producto retirado de la británica GSK para el tratamiento de los síntomas de autismo, a pesar de la falta de un claro respaldo científico. A pedido de la FDA, el laboratorio británico presentó una solicitud para el uso del producto para tratar la deficiencia de folato cerebral. A base de leucovorina, también conocida como ácido folínico, el producto ya tiene varias versiones genéricas, y GSK dejó de fabricar su versión de marca en 1997. Ver FDA autismo, paracetamol y leucovorina
En tanto, la norteamericana Eli Lilly recibió el aval de la FDA para Inluriyo, el que se convirtió en la segunda aprobación del regulador estadounidense para un degradador selectivo del receptor de estrógeno, SERD. A base de imlunestrant, el producto solo está autorizado para el tratamiento del cáncer de mama avanzado con receptores de estrógeno positivos y HER2 negativos que presenta mutaciones en el gen ESR1. Ver La FDA avala Inluriyo de Lilly
En paralelo, la FDA autorizó el primer producto de la californiana Crinetics, bautizado Palsonify. A base de paltusotina, está indicado en adultos con acromegalia para quienes la cirugía no funcionó o no es una opción. Esta es una afección rara causada por un tumor benigno en la hipófisis, la que provoca una sobreproducción de la hormona del crecimiento en el cerebro. Ver FDA autoriza Palsonify
La norteamericana Medtronic recibió la aprobación de la FDA para una terapia de neuromodulación para la incontinencia urinaria de urgencia. El dispositivo Altaviva se inserta cerca del tobillo y envía impulsos eléctricos para regular el control de la vejiga. Ver FDA: luz verde para Altaviva
Y cerca del fin de mes, la FDA aprobó Qivigy, una terapia de inmunoglobulina intravenosa de Kedrion Biopharma. La misma está indicada para el tratamiento de adultos con inmunodeficiencia humoral primaria, IP. La empresa italiana, especialista en plasma, aumentará sus inversiones en EE.UU para apoyar el lanzamiento del producto. Ver FDA: OK para Qivigy
Mientras tanto, MEDRxCo recibió el OK para Bondlido, un sistema anestésico local tópico de tipo amida indicado para el alivio del dolor asociado con la neuralgia posherpética, NPH, en adultos. El producto es un nuevo tipo de parche de lidocaína, un anestésico local. Utiliza el Ionic Liquid Transdermal System de MEDRx diseñada para aumentar la permeabilidad transdérmica de los medicamentos. La NPH es la complicación a largo plazo más común del herpes zóster, culebrilla.
El último día del mes, la FDA dio la luz verde a Rhapsido, remibrutinib, de Novartis. El producto es el primer inhibidor de la quinasa indicado para el tratamiento de la urticaria crónica espontánea, UCE. Está indicado para pacientes adultos que permanecen sintomáticos a pesar del tratamiento con antihistamínicos H1. La píldora se toma dos veces al día, y no requiere inyecciones ni controles de laboratorio. Ver Press Release
Por último, la FDA cerró el mes con la aprobación condicional de Dectomax-CA1 de Zoetis como el primer producto autorizado en EE.UU para la prevención y el tratamiento de infestaciones causadas por larvas de Cochliomyia hominivorax, miasis, conocido como el gusano barrenador del ganado. Este inyectable está indicado para la prevención de reinfestaciones durante 21 días en ganado vacuno exclusivo para producción cárnica, vacas lecheras menores de 20 meses, vacas gestantes, terneros recién nacidos y toros. Ver Press Release