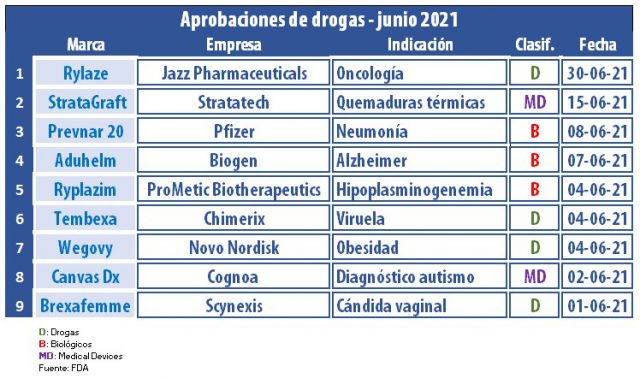
El primer semestre del año llegó a su fin y la FDA no frenó su ritmo. En el mes de junio la agencia regulatoria de los Estados Unidos le dio luz verde a nuevas moléculas, biológicos y devices, tanto para el tratamiento del COVID-19 como para otras condiciones.
En el cierre de la primera mitad del año, la pandemia del COVID-19 sigue bajo la lupa de la FDA. Sin embargo, el organismo regulatorio también le levantó el pulgar a otros tratamientos extra coronavirus.
Por caso, en junio resaltó el visto bueno para Aduhelm, un producto desarrollado por la norteamericana Biogen en conjunto con la japonesa Eisai. Se trata de la primera terapia modificadora del Alzheimer. Esto es en función de que los medicamentos disponibles hasta el momento apuntan sólo a tratar los síntomas. Sin embargo, Aduhelm requerirá un estudio clínico post-aprobación para verificar si proporciona el beneficio esperado. Ver «FDA avala Aduhelm de Biogen, Alzheimer».
La norteamericana Pfizer también anotó un aval en este mes. Fue para Prevnar 20, una nueva vacuna conjugada para la neumonía, indicada para adultos mayores de 18 años. El biológico comprende los conjugados para los 13 serotipos ya incluidos en la vacuna Prevnar 13, a la vez que suma otros para siete serotipos adicionales que están asociados con altas tasas de letalidad. Ver «FDA aprobó Prevnar 20, Pfizer«.
En tanto, casi al filo del cierre del mes, la que recibió el sí fue Jazz Pharmaceuticals. La biofarmacéutica irlandesa logró la aprobación de Rylaze, como componente de un régimen de quimioterapia para leucemia linfoblástica aguda y linfoma linfoblástico en personas alérgicas a la asparaginasa derivada de E. coli.1. El medicamento fue avalado por vía rápida y designado droga huérfana. En tanto, el proceso se dio en el marco del Proyecto Orbis, para el que en esta oportunidad la FDA colaboró con Health Canada. Ver Press Release FDA. Ver Press Release Jazz.
La agencia le dio el OK a Tembexa, de la británica Chimerix. Se trata de un antiviral indicado para la viruela, que si bien fue erradicada, desde hace tiempo Estados Unidos estima que su virus podría ser utilizado como arma biológica. El medicamento fue avalado como contramedida médica, es decir para ser utilizado en caso de que ocurriera una emergencia sanitaria. Ver «FDA aprueba Tembexa para viruela».
Otro de los medicamentos que recibió la venia por parte de la FDA fue Ryplazim, de ProMetic Biotherapeutics., una división de la canadiense Liminal BioSciences. El producto se posiciona como el primer tratamiento para la deficiencia de plasminógeno tipo 1, también conocida como hipoplasminogenemia, que puede provocar ceguera. Ver Press Release FDA. Ver Press Release Liminal BioSciences.
La FDA también respaldó a Wegovy, de la danesa Novo Nordisk, el que está indicado para el control de peso crónico en adultos con obesidad o sobrepeso con al menos una afección relacionada -como presión arterial alta, diabetes tipo 2 o colesterol alto-. Esta inyección, a base de semaglutida, es de aplicación semanal y como complemento de una dieta baja en calorías y de mayor actividad física. Ver «Novo suma fichas a la obesidad, FDA».
Por otro lado, el organismo le levantó el pulgar a las tabletas Brexafemme, de la norteamericana Scynexis, para la candidiasis vulvovaginal. De acuerdo con la compañía, el producto se posiciona como el primer antifúngico a base de ibrexafungerp para infecciones vaginales por hongos, y cuyo tratamiento dura un solo día. Ver Press Release Scynexis.
En el wing de los devices, la agencia regulatoria autorizó a Cognoa ASD Diagnosis Aid, de la norteamericana Cognoa. Se trata de un software basado en aprendizaje automático, destinado a ayudar a diagnosticar el trastorno del espectro autista en niños de 18 meses a 5 años. Ver Press Release Cognoa. Ver Press Release FDA.
Asimismo, el organismo respaldó StrataGraft para quemaduras térmicas que contienen elementos cutáneos intactos y para las que la intervención quirúrgica está clínicamente indicada. El producto, diseñado con capas dérmicas y epidérmicas compuestas por células humanas, fue designado como terapia avanzada de medicina regenerativa. Lleva el sello de Stratatech, una compañía del grupo irlandés Mallinckrodt. Ver Press Release FDA. Ver Press Release Stratatech.