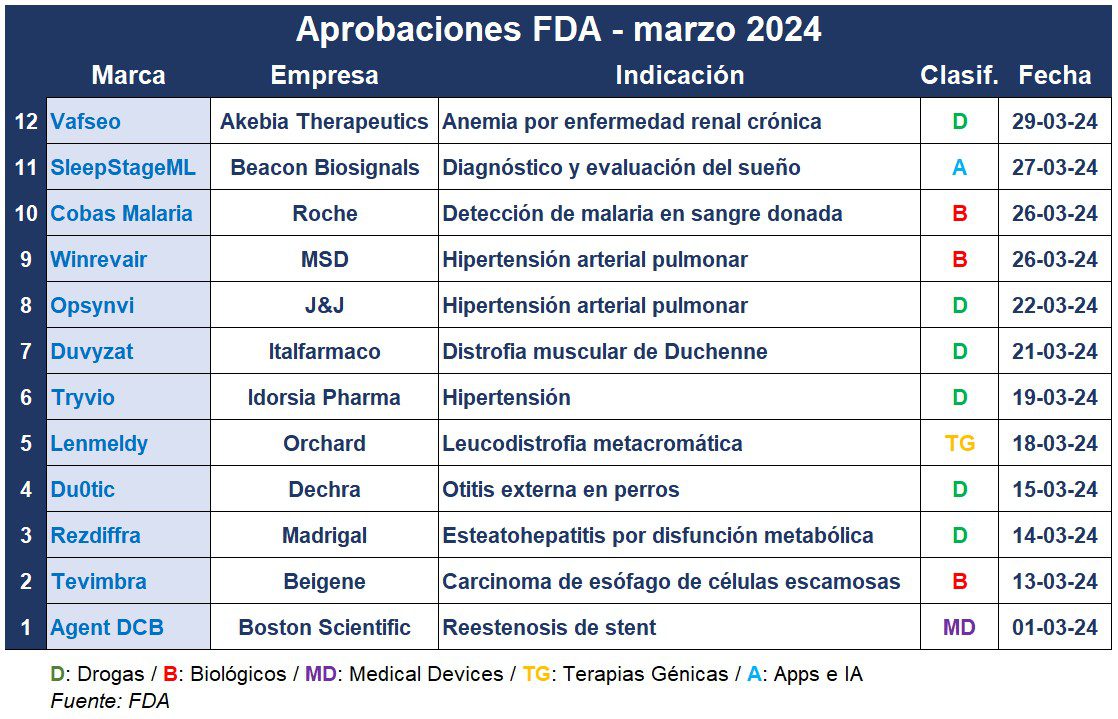
La FDA cerró el tercer mes del año superando la decena de aprobaciones nuevas. Entre estas se encuentra una terapia génica para una enfermedad genética en niños, un oncológico para el carcinoma de estómago, y un medicamento para quienes no responden a otros tratamientos para la hipertensión.
Marzo arrancó con el visto bueno para un device de la norteamericana Boston Scientific y por parte de la FDA. Se trata de Agent Drug-Coated Balloon o «DCB», el primer catéter con balón recubierto de medicamento en los EE.UU. para tratar la reestenosis coronaria dentro del stent en pacientes con un tipo de enfermedad cardíaca. Ver FDA aprueba Agent
En tanto, la china Beigene, comandada en la Argentina por Eduardo Molinari, recibió el OK para Tevimbra, apuntada a adultos con carcinoma de esófago de células escamosas metastásico o irresecable. Tevimbra es un anticuerpo monoclonal anti-PD-1, una clase de tratamiento similar a Keytruda, el blockbuster de MSD, que ayuda al sistema inmunológico del cuerpo a detectar y atacar tumores. El producto estará disponible en Estados Unidos en la segunda mitad del año. Ver FDA aprueba Tevimbra
También en marzo, la agencia regulatoria le dio luz verde al nuevo desarrollo de la norteamericana Madrigal Pharmaceuticals. Se trata de una terapia para el tratamiento de la esteatohepatitis asociada a disfunción metabólica, o MASH por sus siglas en inglés, la que se estima afecta a alrededor del 5% de los adultos en el hemisferio norte. Rezdiffra, a base de resmetirom, recibió una aprobación acelerada, y consiste de un comprimido de una dosis por día. Ver FDA aprueba Rezdiffra
La británica Dechra consiguió el visto bueno para DuOtic. Este es un gel ótico para el tratamiento de la otitis externa asociada con cepas susceptibles de hongos en perros. El producto veterinario es el primero que la FDA autoriza para tratar exclusivamente a la otitis externa con candidiasis en perros y el primer producto ótico para la otitis externa que no contiene antibióticos. Ver FDA aprueba DuOtic
Lenmeldy, la primera terapia génica para tratar niños con leucodistrofia metacromática, una enfermedad genética rara y debilitante que afecta el cerebro y el sistema nervioso, recibió el OK de la FDA. Se trata de un producto de Orchard Therapeutics, un laboratorio británico que fue comprado por Kyowa Kirin en enero. Lenmeldy fue designado como huérfano, recibió una revisión prioritaria, y se convirtió en el medicamento más caro de Estados Unidos tras su aprobación. Ver FDA aprueba Lenmeldy | Ver Lenmeldy: el nuevo medicamento más caro
La suiza Idorsia Pharma también consiguió una aprobación. Tryvio, un producto que re-adquirió de J&J el año pasado, fue desarrollado para tratar la presión arterial alta en combinación con otros medicamentos antihipertensivos en pacientes que no obtienen un control adecuado con otros medicamentos. La empresa dice que creará una estrategia de lanzamiento durante los próximos meses para tener el producto disponible durante la segunda mitad de este año. Ver FDA aprueba Tryvio
En tanto, Opsynvi de Johnson & Johnson se convirtió en la única terapia combinada de un solo comprimido para la hipertensión arterial pulmonar. Es una combinación de Opsumit de J&J y Adcirca de United Therapeutics, los que comúnmente se recetan juntos para tratar esta enfermedad rara y de rápida progresión. Tadalafilo, el ingrediente activo de Adcirca, lleva 20 años en el mercado. Su presentación más conocida es la de Cialis, el producto para la disfunción eréctil de Eli Lilly, el que se basa en tadalafilo de 5, 10 y 20mg. Mientras que Opsumit fue aprobado en el 2013 en versión de 20mg y para HAP. Ver Press Release
Para el mismo diagnóstico surgió también Winrevair de la norteamericana MSD. El mismo es el primer producto en su clase. A base de sotatercept, un inhibidor de la señalización de la activina, Winrevair en un biológico que actúa directamente sobre el problema subyacente. MSD informó que cobrará u$s 14.000 por un vial, el que se dosifica por vía subcutánea cada tres semanas, lo que sitúa su costo anual en u$s 238.000. Ver FDA aprueba Winrevair
Duvyzat, el primer producto no esteroideo aprobado para tratar a pacientes con todas las variantes genéticas del trastorno hereditario conocido como distrofia muscular de Duchenne o DMD, recibió luz verde de la FDA. De la italiana Italfarmaco, el tratamiento a base de givinostat ayuda a regular un grupo de enzimas responsables de causar daño y deterioro muscular en pacientes con DMD. El mismo se enfrentará a medicamentos como Exondys 51, Vyondys y Amondys de la estadounidense Sarepta Therapeutics. Ver FDA aprueba Duvyzat
Además, la FDA le dio el OK a Cobas Malaria, el primer test de prueba molecular para detectar la presencia de malaria en donantes de sangre, órganos y tejidos. Este desarrollo de la suiza Roche es una prueba cualitativa de detección de ácido nucleico in vitro que detecta las cinco especies principales de los parásitos Plasmodium. La nueva prueba estará disponible en los Estados Unidos a finales del segundo trimestre de este año, y la multi prevé la aprobación en la Unión Europea con la marca CE a finales del 2024. Ver FDA aprueba Cobas Malaria
Llegando el final del mes, la FDA autorizó Vafseo de Akebia Therapeutics para tratar la anemia causada por la enfermedad renal crónica (ERC) en pacientes en diálisis. A base de vadadustat, el producto es un inhibidor del factor prolil hidroxilasa (HIF-PH) inducible por hipoxia. Anteriormente, la FDA lo había rechazado por motivos de seguridad, ya que planteaba un mayor riesgo de formación de coágulos sanguíneos y lesiones en el hígado, aunque el producto ya está aprobado en 37 países, incluyendo Europa, Australia y Taiwan. Ver Press Release
Finalmente, el regulador estadounidense autorizó SleepStageML, un software de aprendizaje automático de Beacon Biosignals que organiza el sueño a partir de señales de electroencefalograma (EEG) de registros de polisomnografía clínica (PSG). El objetivo del software es ayudar en el diagnóstico y evaluación del sueño y trastornos relacionados. Este último aval complementa la autorización de la diadema portátil Dreem 3S y los algoritmos integrados, proporcionando una solución integral para medir el sueño en entornos domésticos y clínicos.