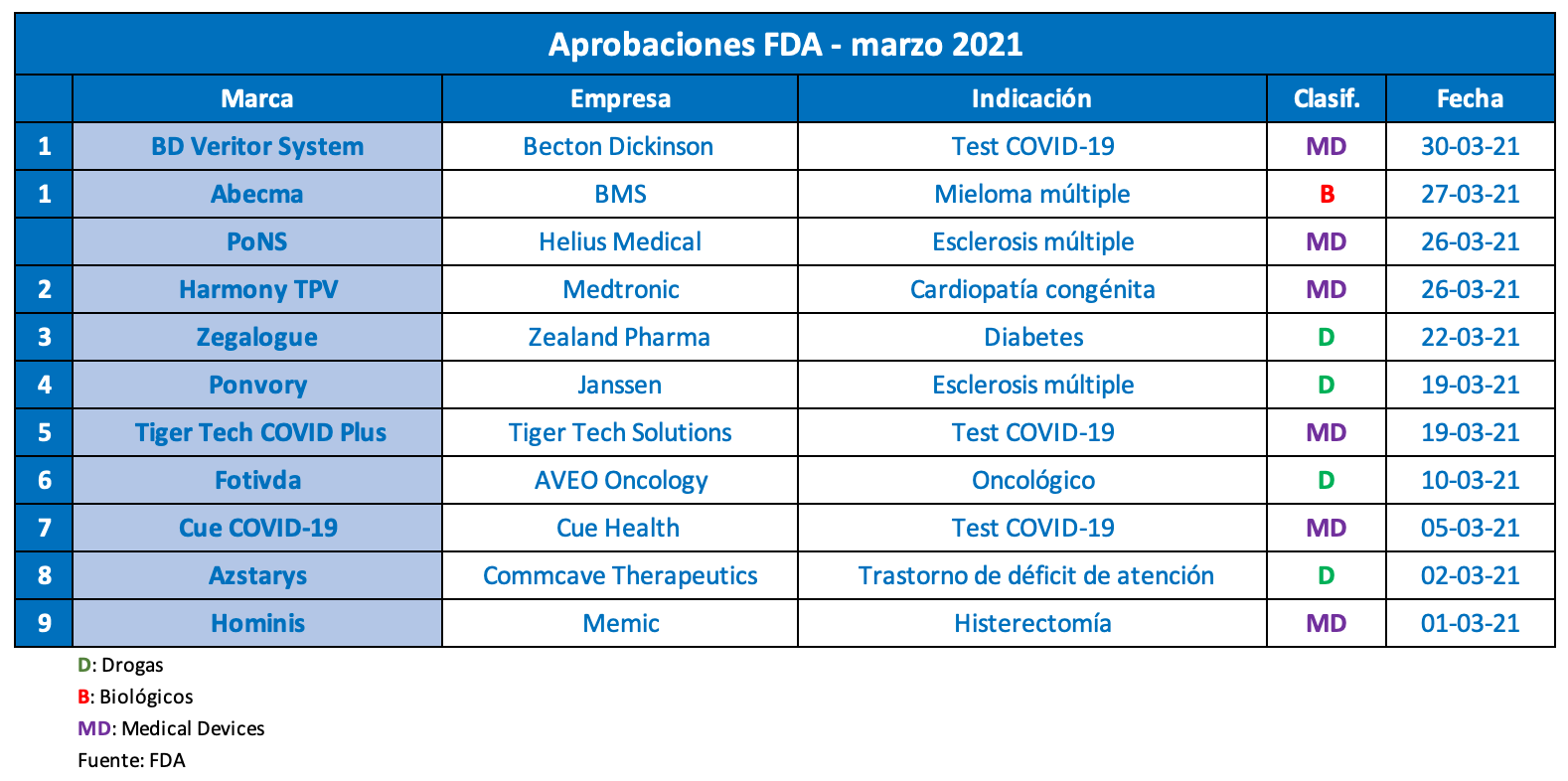
El tercer mes de este año cierra con múltiples autorizaciones desde la FDA, en materia de nuevas moléculas y medical devices, destinados tanto a la detección del COVID-19 como al tratamiento de otras enfermedades. El equipo de Pharmabiz publica un nuevo reporte que lista los principales productos avalados.
La pandemia alcanzó su primer año, pero la FDA no pierde el ritmo de aprobaciones. En este segundo marzo signado por el coronavirus, la agencia respaldó terapias y dispositivos médicos para diversas indicaciones.
Por caso, a menos de un mes de anotar el OK para su vacuna anti COVID-19, la norteamericana Janssen recibió otro aval de la agencia reguladora. En esta oportunidad fue para Ponvory, un tratamiento oral indicado para adultos con esclerosis múltiple recidivante, que apunta a reducir las recaídas anuales y las lesiones cerebrales. Ver artículo Ponvory. Ver Press Release Janssen.
En tanto, la estadounidense BMS sigue sumando biológicos apoyados en las terapias génicas. Casi dos meses después de obtener el sí para Breyanzi, ahora la compañía obtuvo la venia para Abecma. Se trata de un producto basado en células T e indicado para mieloma múltiple reincidente o refractario. Ver artículo.
En paralelo, el organismo le dio el visto bueno a Azstarys, un nuevo tratamiento para el trastorno por déficit de atención con hiperactividad (TDAH) en mayores de seis años. El mismo lleva la firma de la norteamericana Commcave Therapeutics. Ver press release.
Otro que recibió el OK este mes fue Fotivda, de la estadounidense AVEO Oncology. El medicamento se presenta como un inhibidor de la quinasa, indicado para adultos con carcinoma avanzado de células renales en recaída o refractario después de dos o más terapias sistémicas previas. Ver press release AVEO. Ver press release FDA.
Asimismo, la FDA le levantó el pulgar a Zegalogue, para el tratamiento de la hipoglucemia grave en mayores de seis años con diabetes. Este inyectable, disponible mediante un autoinyector como en una jeringa precargada, lleva el sello de la biotecnológica dinamarquesa Zealand Pharma. Ver Press Release Zealand.
Por el lado de los devices también hubo novedades. La agencia aprobó la comercialización de un nuevo dispositivo quirúrgico asistido por robot (RASD). Se trata del sistema Hominis, diseñado por la israelí Memic para facilitar la histerectomía transvaginal. Ver artículo.
Además, el organismo le dio el OK a Harmony TPV, la primera válvula cardíaca no quirúrgica para personas con cardiopatías congénitas. El producto, que sale bajo el paraguas de la irlandesa Medtronic, recibió la designación de dispositivo disruptivo y fue avalado mediante una colaboración conjunta con la agencia regulatoria de Japón. Ver Press Release.
En tanto, la norteamericana Helius Medical consiguió el visto bueno para su device Portable Neuromodulation Stimulator (PoNS), indicado para el déficit de la marcha debido a síntomas de la esclerosis múltiple. Se trata de un estimulador neuromuscular no implantable que genera pulsos eléctricos a fin de colaborar en el tratamiento de déficits motores a corto plazo. Ver Press Release.
Aprobaciones COVID-19
En paralelo, la FDA continúa activa con autorizaciones de uso de emergencia de tests para detectar el coronavirus. Por un lado, el organismo le dio luz verde al primer device de diagnóstico hogareño, de tipo molecular, que no requiere de prescripción médica. El mismo lleva la etiqueta Cue COVID-19, de la norteamericana Cue Health. Ver artículo.
Por otro lado, la agencia le otorgó el OK al monitor Tiger Tech COVID Plus, de la también norteamericana Tiger Tech Solutions. Este device se consolida como el primer dispositivo de detección basado en aprendizaje automático, para identificar ciertos biomarcadores que pueden indicar una infección por COVID-19. Ver Press Release FDA.
Además, al filo del cierre del mes, Becton Dickinson obtuvo la autorización de emergencia para un test rápido que identifica no sólo el COVID-19 sino también la influenza A y B. El device bautizado BD Veritor System distingue los tres tipos de virus en cerca de 15 minutos. Ver Press Release.