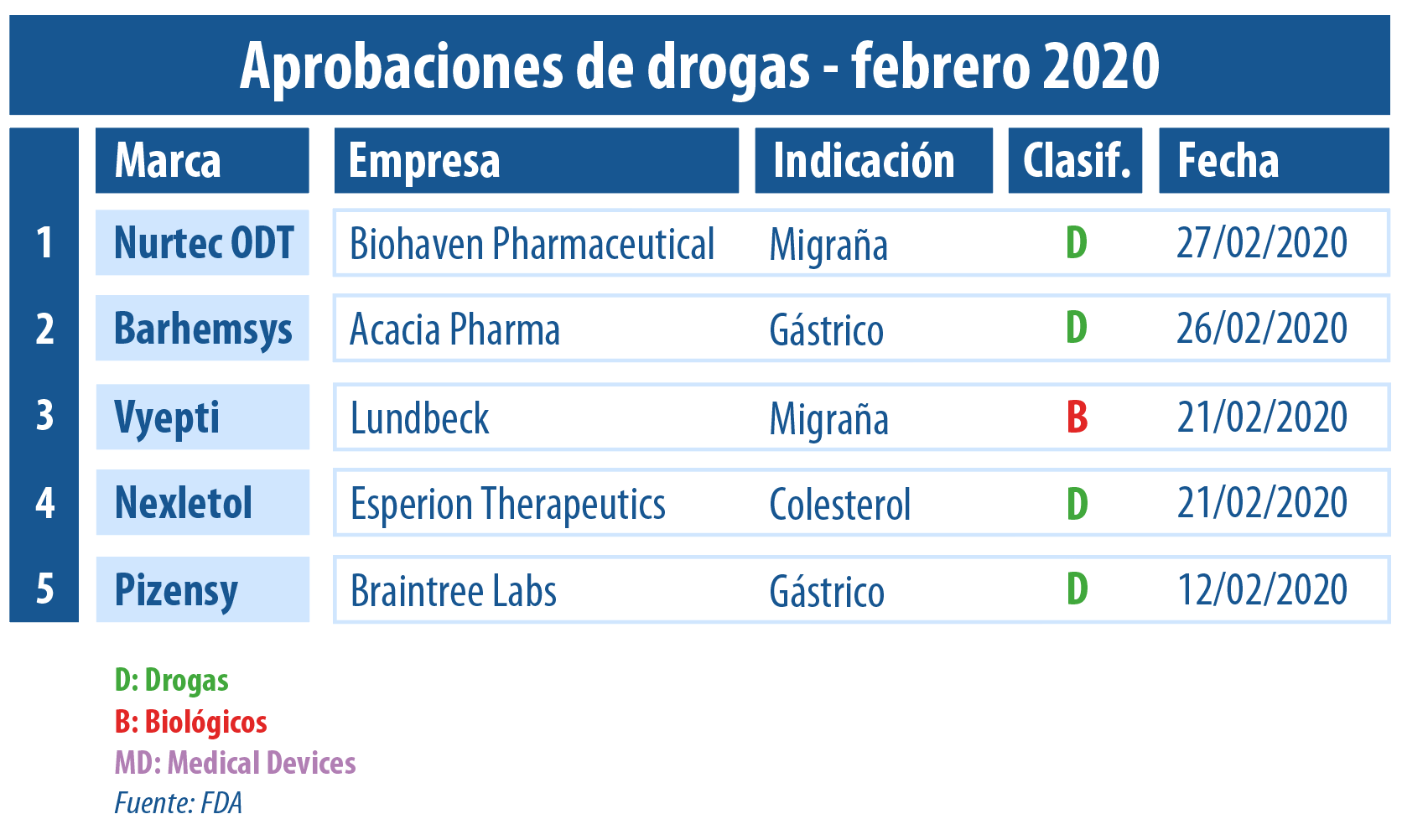
En el segundo mes del año, la FDA aprobó al menos cinco nuevas moléculas. Una de ellas pertenece a la danesa Lundbeck, una firma que opera en la Argentina. La terapia lleva el nombre de Vyepti y está indicada para la prevención de la migraña.
Finalizado el mes de febrero, Pharmabiz realizó un resumen que da cuenta de las principales aprobaciones otorgadas por parte de la FDA.
Por caso en dicho período la agencia avaló a Vyepti, la primera terapia intravenosa que previene la migraña. Este biológico fue desarrollado por la danesa Lundbeck y apunta a personas adultas. Según lo comunicado, estará disponible en el mercado de los Estados Unidos a partir de abril de este año. Ver artículo.
En sintonía la FDA le levantó el pulgar a un medicamento para el tratamiento agudo de la migraña. El organismo autorizó a Nurtec ODT de la norteamericana Biohaven Pharmaceutical, que se constituyó como el primer OK regulatorio para esta empresa enfocada en terapias innovadoras para enfermedades neurológicas. Ver press release.
A lo largo de febrero, dos empresas recibieron sus primeras autorizaciones por parte del organismo. Tales fueron los casos de la norteramericana Biohaven Pharmaceutical, que consiguió el visto bueno para Nurtec ODT; y de la británica Acacia Pharma, que obtuvo el OK para Barhemsys.
Asimismo, el organismo regulatorio le dio luz verde a Nexletol. El producto lleva el sello de la norteamericana Esperion Therapeutics y es el primero en formato oral sin estatinas indicado para reducir el colesterol malo, LDL. Esta terapia será introducida al mercado estadounidense a partir del 30 de marzo de este 2020. Ver press release.
Por otro lado, la FDA le otorgó la venia a Pizensy de la norteamericana Braintree Labs. Se trata de un laxante osmótico que está indicado para adultos con constipación idiopática crónica. Todavía la compañía no tiene programada su fecha de lanzamiento. Ver comunicado.
En tanto, la FDA aprobó a Barhemsys de la británica Acacia Pharma. El mismo apunta a combatir y prevenir las náuseas y los vómitos postoperatorios asociados a la anestesia, en adultos. Es el primer producto de la empresa que obtiene el aval del organismo, y comenzaría a comercializarse en los Estados Unidos durante la segunda mitad del 2020. Ver press release.