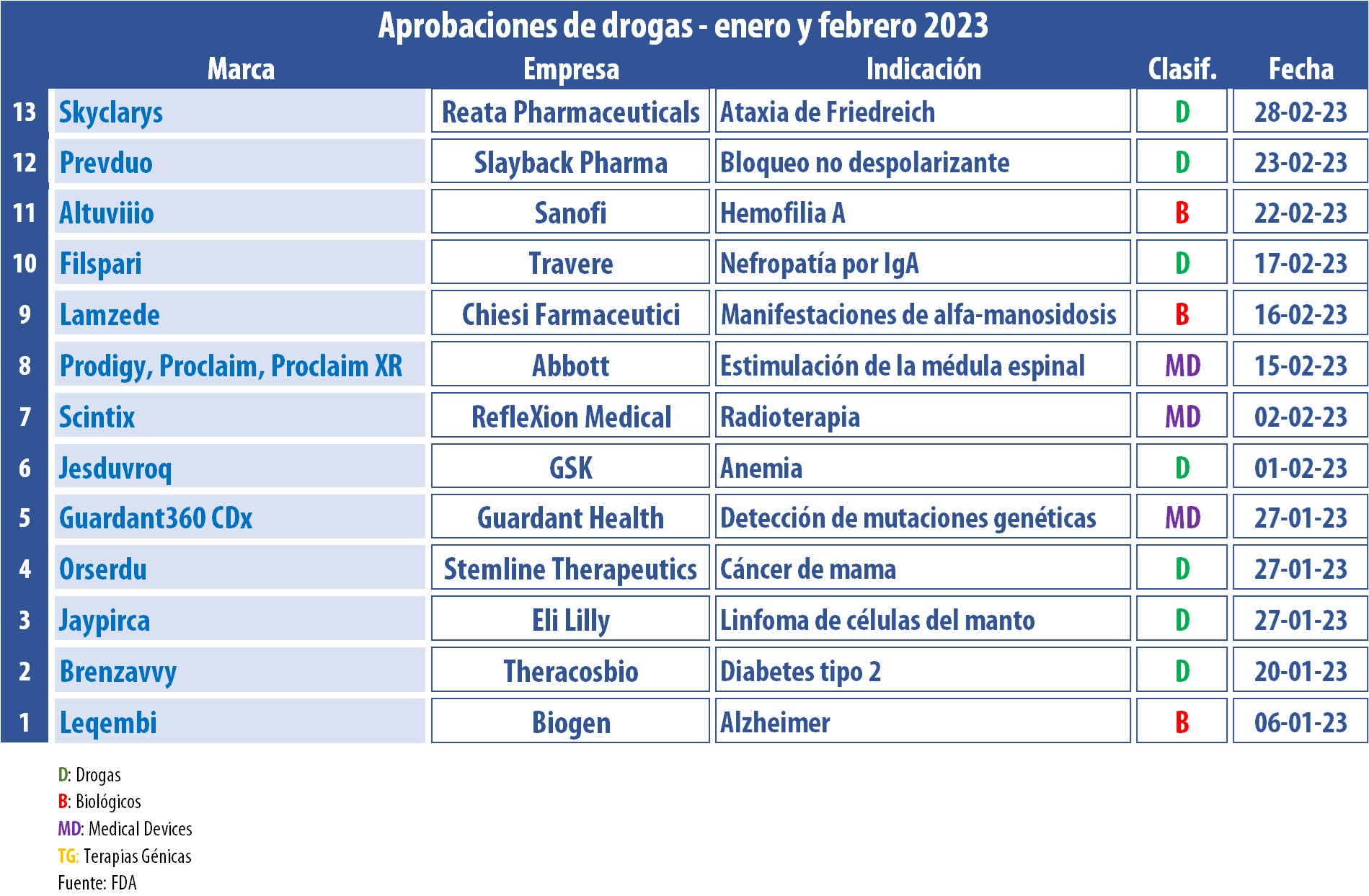
Durante los primeros dos meses del año, la FDA le dio el visto bueno a más de una docena de nuevos productos. En la lista se destacan oncológicos; una dupla de biológicos; y un device para controlar el dolor crónico causado por la neuropatía periférica diabética; entre otros.
La FDA arrancó el 2023 súper activa. A la fecha, le dio luz verde a más de una decena de nuevos tratamientos.
El regulador estadounidense aprobó Jayprica, de la norteamericana Eli Lilly. Se trata del primer inhibidor de BTK no covalente, indicado para adultos con linfoma de células del manto, una forma rara de cáncer de la sangre. El producto fue consignado para casos de recaída o refractarios, y para su uso después de dos líneas de terapia sistémica, incluido un inhibidor de BTK. Ver artículo Eli Lilly.
A su vez, la FDA autorizó por vía acelerada Leqembi, a base de lecanemab, para las primeras fases de la enfermedad de Alzheimer. El tratamiento, desarrollado por la norteamericana Biogen en conjunto con la japonesa Eisai, apunta a enlentecer el avance de la enfermedad, eliminando del cerebro los grumos pegajosos de la proteína tóxica beta amiloide. Ver artículo Biogen.
También la agencia le levantó el pulgar Jesduvroq, a base de daprodustat, de la británica GSK. El medicamento fue respaldado como el primer tratamiento oral para la anemia causada por la enfermedad renal crónica. El medicamento está indicado para adultos que recibieron diálisis durante al menos cuatro meses. Ver artículo Jesduvroq.
Otro que recibió el aval durante este periodo fue Altuviiio, de la francesa Sanofi. Este biológico fue indicado para la profilaxis de rutina, el tratamiento a demanda, el control de los episodios hemorrágicos y el control perioperatorio de las hemorragias en personas con hemofilia A. Se trata de una terapia que reemplaza el factor de coagulación de la sangre faltante, la proteína factor VIII. Ver artículo Sanofi.
La norteamericana Stemline y miembro del grupo Menarini también obtuvo un OK por parte del organismo. Su producto Orserdu, a base de elacestrant, fue autorizado para el tratamiento de hombres y mujeres posmenopáusicos con cáncer de mama avanzado o metastásico, luego de al menos una terapia endócrina. En paralelo, la FDA aprobó Guardant360 CDx, como un dispositivo de diagnóstico complementario. La prueba de laboratorio, diseñada para detectar mutaciones genéticas que se encuentran en el ADN circulante libre de células (cfDNA), lleva el sello de la norteamericana Guardant Health. Ver Press Release Stemline / Ver Press Release Guardant.
La norteamericana TherascoBio recibió luz verde para sus tabletas a base de bexagliflozin, bajo la marca Brenzavvy. Este inhibidor oral del cotransportador de sodio y glucosa tipo 2, en conjunto con una dieta correcta y ejercicio, apunta a mejorar el control glucémico en adultos con diabetes tipo 2. Ver Press Release Theracosbio.
Además, la FDA aprobó un biológico de la italiana Chiesi. Se trata de Lamzede, la primera terapia de reemplazo enzimático para alfa-manosidosis, una condición genética rara caracterizada por la falta de la enzima alfa-manosidasa. Lamzede es un inyectable que actúa de la misma manera que esta enzima en el cuerpo humano, restaurando así la actividad celular normal. Ver Press Release Chiesi.
El organismo le dio el OK a Filspari, a base a sparsentan, de la norteamericana Travere. Según la empresa, este es el primer tratamiento no-inmunosupresivo para la reducción de la cantidad de proteínas en la orina en personas con nefropatía por IgA, conocida como enfermedad de Berger. Ver Press Release Travere.
Casi al cierre del bimestre, la agencia respaldó a Prevduo, de la estadounidense Slayback Pharma. Se trata de un inyectable que combina una dosis fija de un inhibidor de la colinesterasa y un agente antimuscarínico. El mismo está indicado para mayores de dos años, a fin de revertir los efectos de los bloqueadores neuromusculares no despolarizantes después de una cirugía, a la vez que para disminuir los efectos muscarínicos periféricos. Ver Prospecto Prevduo.
En el wing de los medical devices, la FDA avaló los sistemas de estimulación de la médula espinal Prodigy, Proclaim, and Proclaim XR. Estos implantes, desarrollados por la norteamericana Abbott, funcionan a través de un generador de impulsos y apuntan a controlar el dolor crónico en el tronco y en las extremidades, causado por neuropatía periférica diabética. Ver Press Release Abbott.
La lista de aprobaciones sigue con Scintix, de la norteamericana RefleXion. Este es un sistema para radioterapia que permite que la biología única de cada cáncer determine de forma autónoma dónde y cuánta radiación administrar, segundo a segundo, durante el tratamiento. Scintix está indicado para cáncer en los huesos y en los pulmones. Ver Press Release RefleXion.
Finalmente, cerca del final del último del mes, y un día después de que el regulador anunciara la repentina salida de su jefe de neurociencias Billy Dunn, la FDA aprobó Skyclarys, a base de omaveloxolone. Es un producto de la estadounidense Reata Pharmaceuticals y el primero aprobado para la ataxia de Friedreich, una enfermedad neuromuscular hereditaria ultra-rara que afecta a cerca de 5.000 pacientes en Estados Unidos. Indicado para tratar a mayores de 16 años, es un medicamento oral de una dosis diaria. El producto ya está bajo evaluación en la Unión Europea. Ver Press Release Reata Pharmaceuticals.
 [/vc_column_text][/vc_column][/vc_row]
[/vc_column_text][/vc_column][/vc_row]














