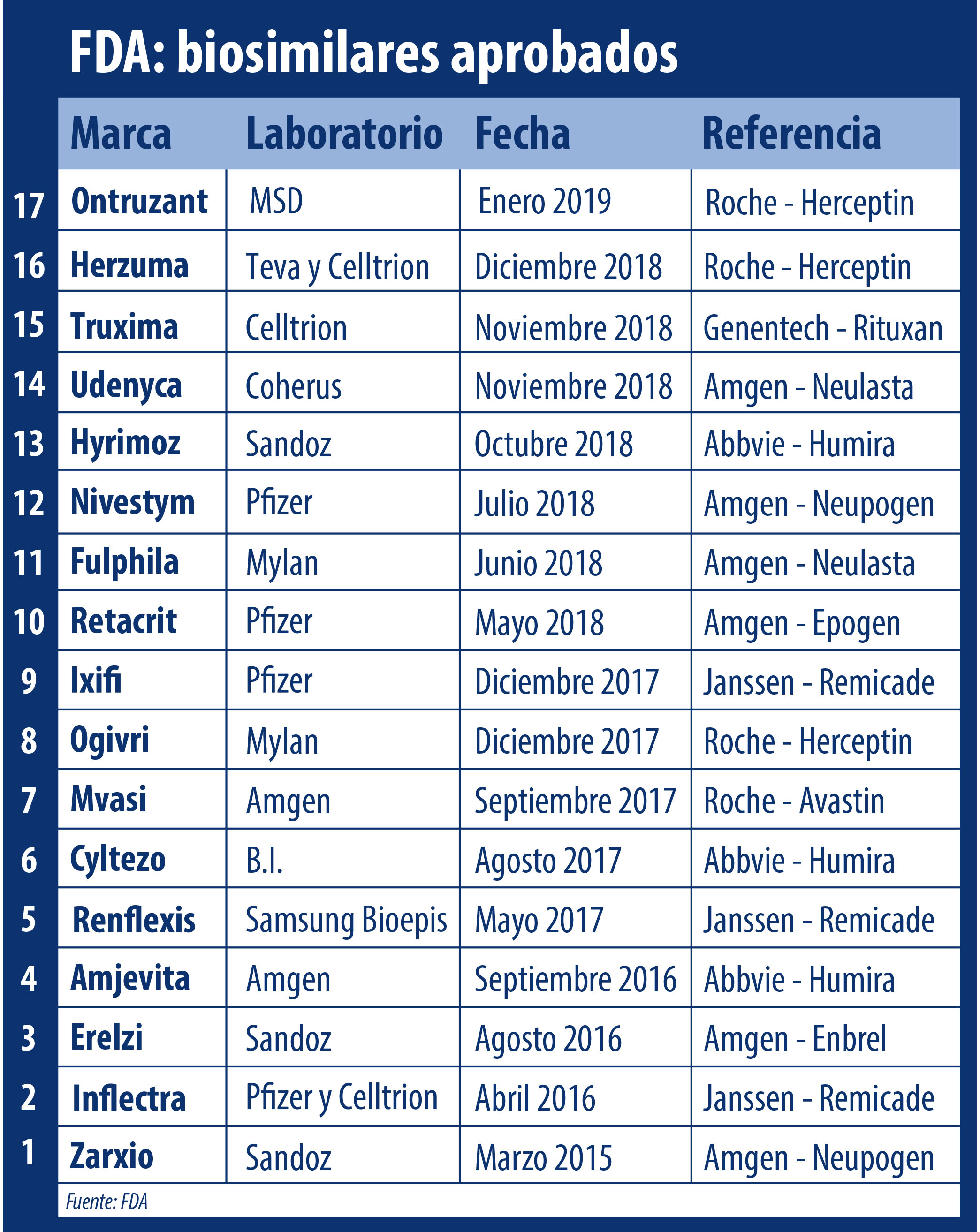
La FDA le dio luz verde al primer biosimilar de este 2019. Se trata de Ontruzant, un producto que toma como antecedente y referencia a Herceptin, de la suiza Roche.
A pesar del shutdown norteamericano, la FDA continúa firme en su misión de seguir aprobando nuevos biosimilares.
Así, el viernes por la tarde la agencia regulatoria le dio el primer visto bueno del año a Ontruzant, un producto que toma como antecedente a Herceptin, de la suiza Roche. Ver press release.
El mismo lleva el sello de la norteamericana MSD en conjunto con Samsung Bioepis, a partir de un joint venture que formaron ambas compañías.
Este es el tercer bioequivalente de Herceptin que avala la FDA. En diciembre pasado también había autorizado a Herzuma, que está bajo el ala de la israelí Teva; y un año atrás le había dado el OK a Ogivri de Mylan. En contraste, Ontruzant fue el primer biosimilar de Herceptin aprobado por la EMA, la que ya suma cinco productos de este tipo con Kanjinti, de Amgen; y Trazimera, de Pfizer. Ver listado.