Los biosimilares empujan cada vez más la competencia en los Estados Unidos. Ahora recibió luz verde el segundo clon de Herceptin de Roche, de la mano de Teva y Celltrion.
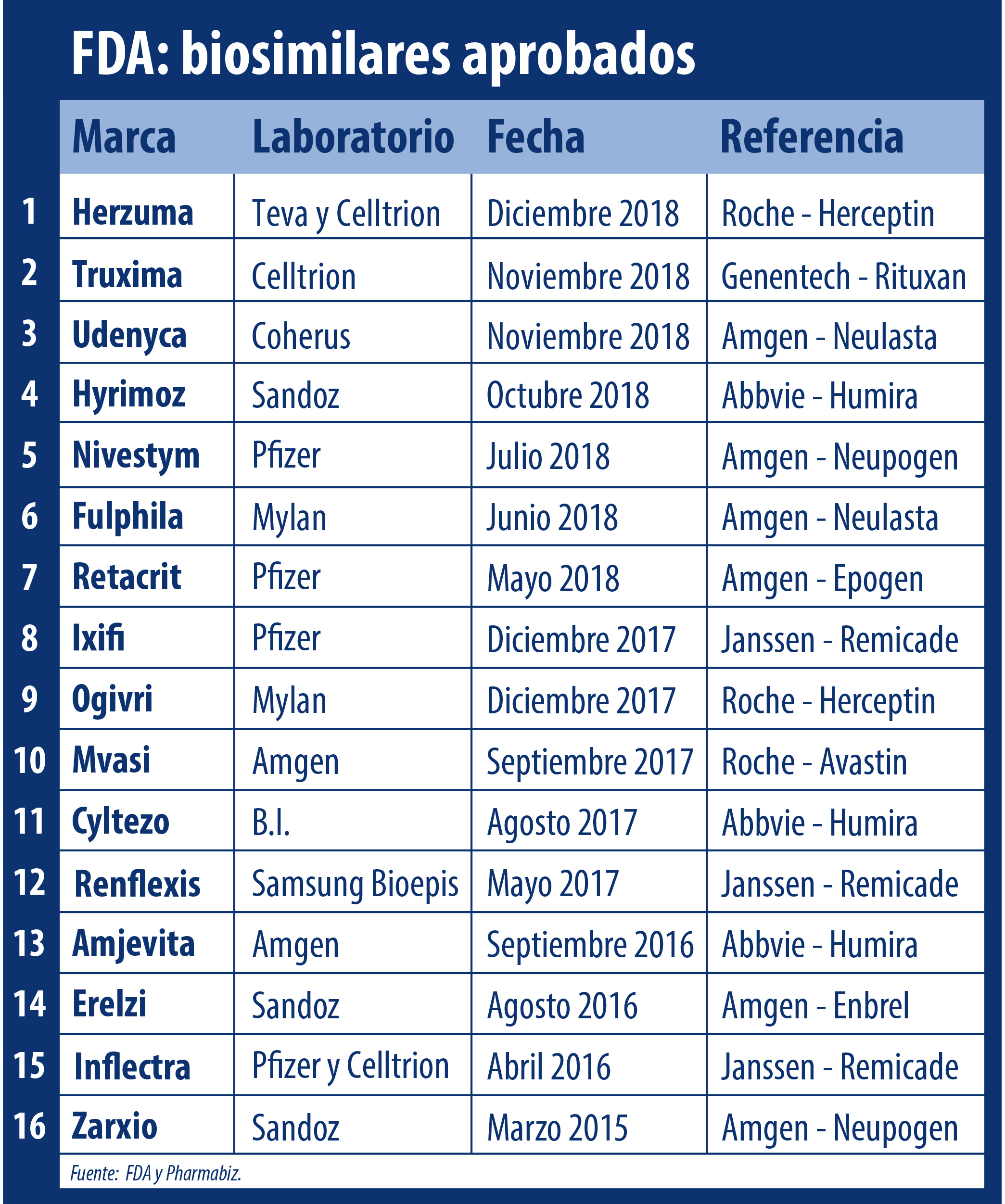
La FDA le dio luz verde a su biosimilar número 16. Se trata de Herzuma, de la israelí Teva, un producto que toma como antecedente y referencia a Herceptin de la suiza Roche. Ver Press Release.
Aunque no es el primero de su tipo. Un año atrás la agencia regulatoria de Estados Unidos ya le había levantado el pulgar a Ogivri de Mylan, que también es un bioequivalente del oncológico de la compañía suiza.
En Europa, sin embargo, son cuatro los biosimilares de Herceptin avalados por la EMA. El primer aprobado fue Ontruzant de Samsung Bioepis, el 15 de noviembre de 2017. En segundo lugar fue avalado Herzuma, en febrero de 2018. En tanto, el tercer biosimilar de este grupo fue Kanjinti de Amgen, autorizado en mayo de este año; y por último Trazimera de Pfizer, que obtuvo el OK en julio pasado. Ver Listado.