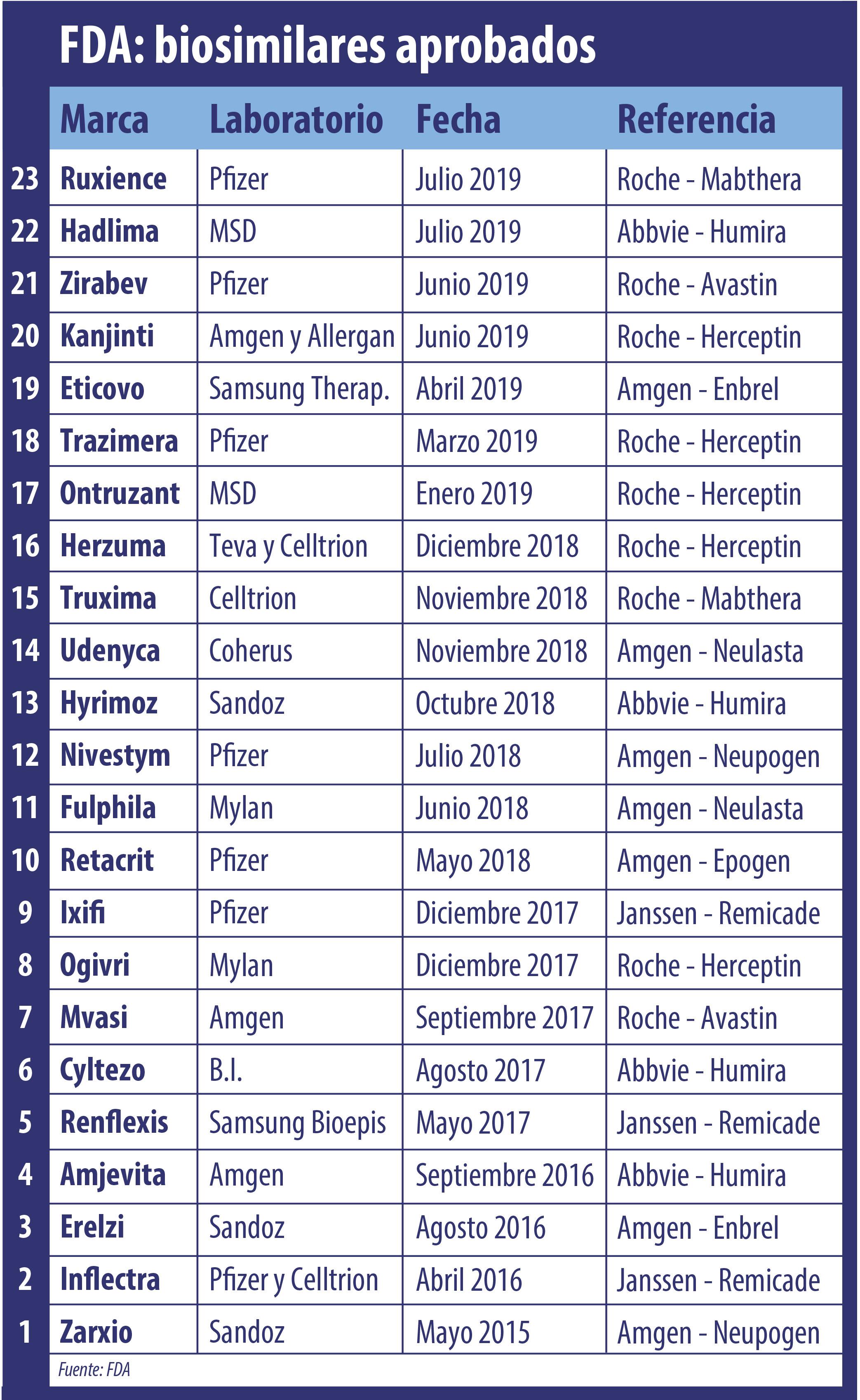
Durante julio la FDA sumó nuevas aprobaciones en materia de biosimilares. Por caso, le dió el OK a Ruxience de Pfizer, el segundo bio del oncológico Mabthera de la suiza Roche.
En el mes de julio la FDA le dio el visto bueno a dos nuevos biosimilares y alcanzó así un total de 23 productos de este tipo aprobados.
Casi al filo del cierre del mes, la agencia regulatoria le levantó el pulgar por un lado a Ruxience, el séptimo bioequivalente que lleva el sello de Pfizer y el segundo que el organismo avala como bio de Mabthera, el oncológico de Roche. El mismo está indicado para linfoma no Hodgkin. Ver press release.
También le concedió luz verde a Hadlima, el que se encuentra bajo el paraguas de MSD y que toma como referencia al emblemático Humira de Abbvie.
El simultáneo, la FDA avaló a Hadlima, el que pertenece a la norteamericana MSD y que tomó como base a Humira, de Abbvie. El producto, para el tratamiento de la artritis reumatoidea, es en realidad manufacturado por Samsung Bioepis y es el cuarto bio que toma como referencia al emblemático medicamento que constituye la gallina de los huevos de oro para Abbvie. Ver press release.
Sin embargo, y según el relevamiento del equipo de analistas de Pharmabiz, tanto Hadlima como el resto de los bioequivalentes de Humira aprobados en el pasado, no serán comercializados en los Estados Unidos hasta el 2023 en función de ciertos acuerdos sellados con Abbvie. Ver artículo Reuters.