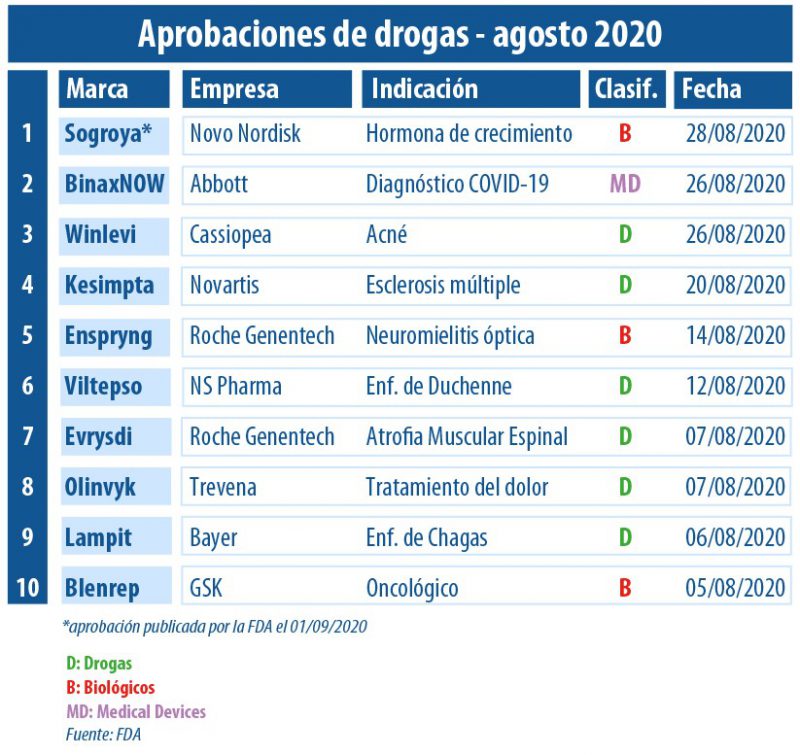
En este agosto de cuarentena, la agencia regulatoria de los Estados Unidos no detuvo su marcha en cuanto a la aprobación de novedades extra COVID-19. En este período, el organismo le dio luz verde a nueve productos entre los que resaltaron seis drogas y dos biológicos.
El checklist de avales de la FDA sumó nuevas moléculas en este agosto de pandemia. Durante este mes, se destacaron nueve productos nóveles que recibieron el OK en Estados Unidos.
La gran estrella fue Evrysdi desarrollado por la biotecnológica Genentech, que forma parte de la suiza Roche, y por la norteamericana PTC Therapeutics. Es un medicamento para la Atrofia Muscular Espinal (AME), que se sube al ring para competir directamente con el híper caro Spinraza de la norteamericana Biogen. Ver artículo.
Además, la multi europea obtuvo otro visto bueno. Fue para el biológico Enspryng indicado para el trastorno del espectro de la neuromielitis óptica. Así se convirtió en la tercera alternativa aprobada para dicha condición. Fue luego de que la agencia norteamericana autorizara en junio Uplizna de Viela Bio, y el año pasado a Soliris de Alexion Pharmaceuticals. Ver artículo.
Entre los principales avales, se destacó una terapia que le podría poner punto final al reinado de Spinraza -el inyectable intratecal de Biogen-. Se trata de Evrysdi desarrollado por la suiza Roche y la norteamericana PTC Therapeutics.
Y otro biológico avalado en agosto fue Blenrep, de la británica GSK, el que apunta a adultos con mieloma múltiple recidivante o refractario. Es una monoterapia para quienes hayan tenido al menos cuatro tratamientos previos -incluido un anticuerpo monoclonal anti-CD38, un inhibidor de proteasoma y un agente inmunomodulador-. Ver artículo.
En el octavo mes del año el coronavirus también dijo presente en el calendario de aprobaciones de la FDA. El que consiguió luz verde fue un device de la norteamericana Abbott. Se trata de BinaxNOW, el que consiste en un test rápido de antígenos para detectar el COVID-19, cuyo diferencial es que los resultados que arroja en 15 minutos, se pueden cargar a una app para smartphones. Este dispositivo que tendrá un precio de u$s 5 en los Estados Unidos, funcionaría a modo de «pase» para transitar por lugares donde hay gran circulación de personas. Ver artículo.
Por otro lado, Lampit de la alemana Bayer se constituyó como el único producto en los Estados Unidos para niños desde su nacimiento hasta los 18 años con la Enfermedad de Chagas. Fue luego de que el organismo le otorgara el visto bueno para dicha indicación al fármaco a base de nifurtimox, que fue lanzado por primera vez en 1970 en la Argentina y poco después también en otros países de Latinoamérica. Ver artículo.
La suiza Novartis por su parte, consiguió el OK de la FDA para Kesimpta, una terapia celular que apunta a la esclerosis múltiple, y que hace 11 años fue avalada originalmente para leucemia linfocítica crónica. Con esta aprobación, la firma tendrá enfrente a Ocrevus, el blockbuster de Roche en el segmento de esclerosis. Ver artículo.
El organismo también le levantó el pulgar a Viltepso, un inyectable a base de viltolarsen, el que pertenece al laboratorio norteamericano NS Pharma, una subsidiaria de la japonesa Nippon Shinyaku. El mismo se constituyó como la segunda «terapia dirigida» avalada para personas con distrofia muscular de Duchenne, un trastorno genético poco común. Ver artículo.
En tanto, la FDA le otorgó el sí al opiáceo Olinvyk que lleva el sello de la norteamericana Trevena. Se trata de una novedad intravenosa de uso hospitalario, que está indicada para el dolor moderado a severo en adultos. Ver Press Release FDA.
La italiana Cassiopea consiguió el visto bueno por parte de la agencia regulatoria para su crema Winlevi a base de clascoterona al 1%. La misma está dirigida a tratar el acné en personas mayores de 12 años y no tiene un enfoque antibiótico, sino que es un inhibidor tópico del receptor de andrógenos. Ver Press Release Cassiopea.