La EMA difundió su informe anual de drogas aprobadas. Durante el 2017, la agencia regulatoria le levantó el pulgar a 92 medicamentos, entre ellos, 35 nuevas sustancias.
La EMA publicó su tradicional informe anual que resume las aprobaciones de nuevos medicamentos durante el 2017. Ver informe.
De acuerdo a lo comunicado, la agencia regulatoria recomendó 92 medicamentos para que sean autorizados, entre ellos 35 nuevas sustancias activas. Durante el 2016, la EMA había avalado un total de 28 flamantes moléculas. Ver artículo.
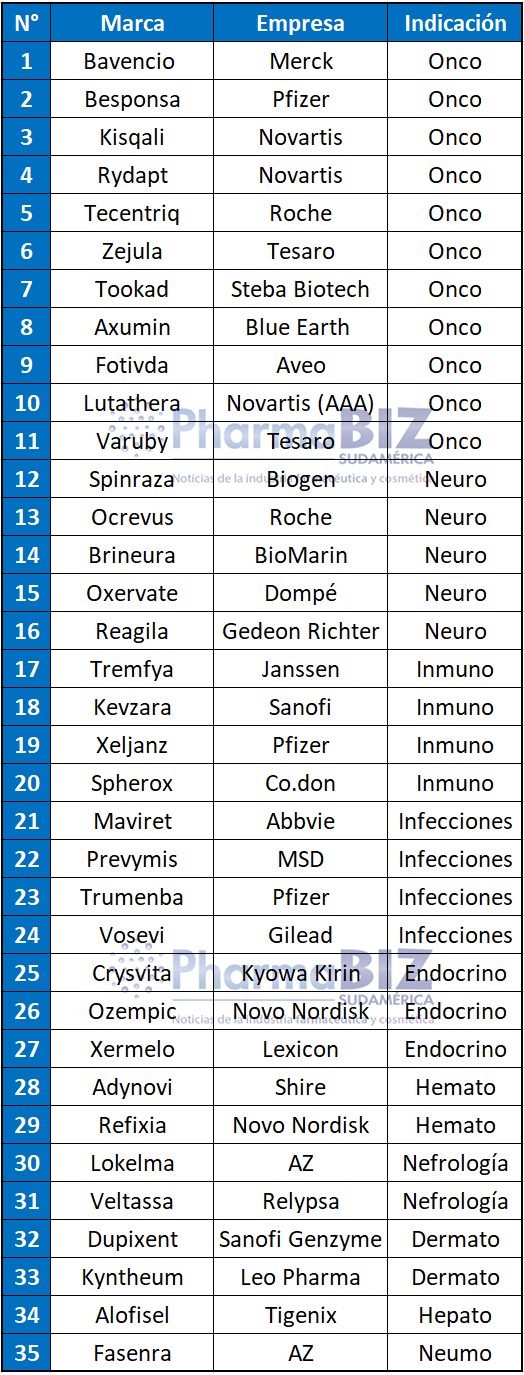
La oncología nuevamente estuvo a la cabeza con 11 productos aprobados en el continente europeo. Le siguió neurología con cinco drogas avaladas.
Según el informe, la EMA aprobó 11 productos oncológicos el año pasado. Figuran Bavencio, de la alemana Merck, indicado para un tipo de cáncer de piel específico; Besponsa, de Pfizer, para tratar la leucemia linfoblástica aguda refractaria; Kisqali de la suiza Novartis, para cáncer de mama. Novartis también obtuvo la venia para Rydapt, con dos indicaciones: leucemia mieloide aguda y trastornos en sangre.
También recibieron el OK Tecentriq, de la suiza Roche, para cáncer de vejiga; Zejula, para cáncer de ovario epitelial recurrente, y Varuby, para náuseas y vómitos asociados a la quimioterapia, ambos de Tesaro; Tookad, de Steba Biotech, para cáncer de próstata; Axumin, un agente radioactivo para detectar cáncer de próstata recurrente en tomografías, de Blue Earth Diagnostics; Fotivda, de EUSA Pharma y AVEO Oncology, para carcinoma de células renales avanzado; y Lutathera, para tumores neuroendocrinos gastroenteropancreáticos, que lleva el sello de Advanced Accelerator Applications, una firma que está siendo adquirida por Novartis. Ver artículo.
Entre las compañías que lograron mayor número de aprobaciones durante el 2017 resaltaron Novartis y Pfizer con 3 avales cada una. Novartis obtuvo el sí para dos oncológicos: Kisqali y Rydapt; y para Lutathera, un producto que está siendo adquirido. Pfizer consiguió el OK para Besponsa; Xeljanz; y Trumenba.
Mientras que en la categoría de Neurología la EMA le levantó el pulgar a cinco nuevas moléculas: Spinraza, de Biogen, para atrofia muscular espinal; Ocrevus, de Roche, para esclerosis múltiple; Brineura, de BioMarin, indicado para la enfermedad de Batten; Oxervate, de Dompé, para queratitis neurotrófica; y Reagila, de Gedeon Richter, para esquizofrenia.
A su vez, en el segmento de Inmuno los que alcanzaron el sí fueron: Tremfya de Janssen, indicado para tratar la psoriasis; Kevzara, de Sanofi y Regeneron, para artritis reumatoidea; Xeljanz, de Pfizer, para artritis; y Spherox, de Co.Don, para reparar lesiones del cartílago de la rodilla.
El organismo también respaldó cuatro productos para tratar Infecciones. Maviret, de Abbvie, para hepatitis C crónica; Prevymis, de MSD, indicado para prevenir una infección grave en adultos que reciben un tipo de trasplante de células madre; Trumenba, una vacuna de Pfizer para la meningitis B; y Vosevi, de Gilead, para hepatitis C crónica sin cirrosis.
Mientras tanto, en la categoría de Endocrinología, la EMA le concedió la autorización a tres nuevas marcas: Ozempic, un complemento para mejorar el control glucémico en adultos con diabetes tipo 2, que lleva el sello de la danesa Novo Nordisk; Crysvita, de Kyowa Kirin, para hipofosfatemia; y Xermelo de Lexicon, para el síndrome carcinoide. A su vez, en Hematología lograron el visto bueno Adynovi, de la irlandesa Shire, para hemofilia A; y Refixia de Novo Nordisk, para hemofilia B.
La EMA también aprobó los productos Lokelma, de AZ; y Veltassa, de Relypsa, ambos usados en Nefrología. También avaló a los dermatológicos Dupixent, de Sanofi Genzyme; y Kyntheum de Leo Pharma. Mientras que en Hepatología le dio el OK a Alofisel, de Tigenix; y en Neumología a Fasenra, de AZ.
Contiene Flipping Book:














