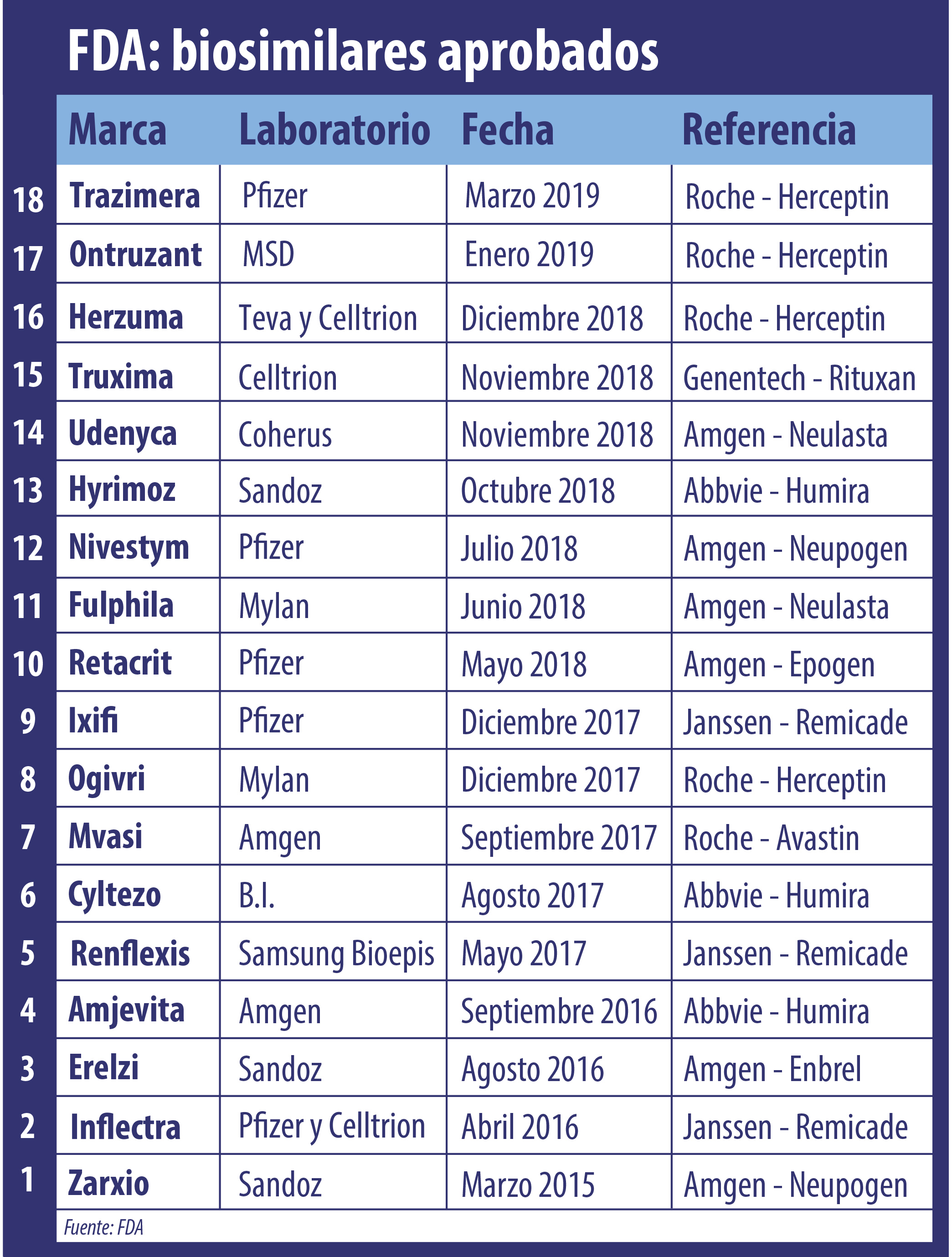
La FDA no detiene su carrera en el campo de los biosimilares. Ahora aprobó el cuarto bio que toma como referencia al oncológico Herceptin de Roche. Se trata de Trazimera, un producto de Pfizer.
La FDA aprobó un nuevo biosimilar de Herceptin. Ya es el segundo del 2019 que toma como referencia al oncológico de Roche y el cuarto que avala el organismo, comandado hasta el momento por Scott Gottlieb. Ver Press Release.
El producto bautizado Trazimera pertenece al laboratorio Pfizer y ya había sido aprobado por la EMA a mediados del año pasado. Ver Informe.
En enero de este año la FDA también le había levantado el pulgar a Ontruzant, el bioequivalente de Herceptin desarrollado por la norteamericana MSD y Samsung Bioepis. Ver artículo.
A su vez, en diciembre del 2018 la agencia le dio luz verde a Herzuma, que está bajo el ala de la israelí Teva; y un año atrás había autorizado a Ogivri de Mylan. Ver artículo. Ver artículo.