En este cierre de semestre, la agencia regulatoria de los Estados Unidos mantuvo su secuencia de aprobaciones para indicaciones extra COVID-19. A lo largo de este período, el organismo le dio el OK a casi una decena de productos.
El cronograma de avales de la FDA avanzó sin pausa en este junio de pandemia. Tal es así, que durante este mes se suma una larga lista de tratamientos nóveles en Estados Unidos.
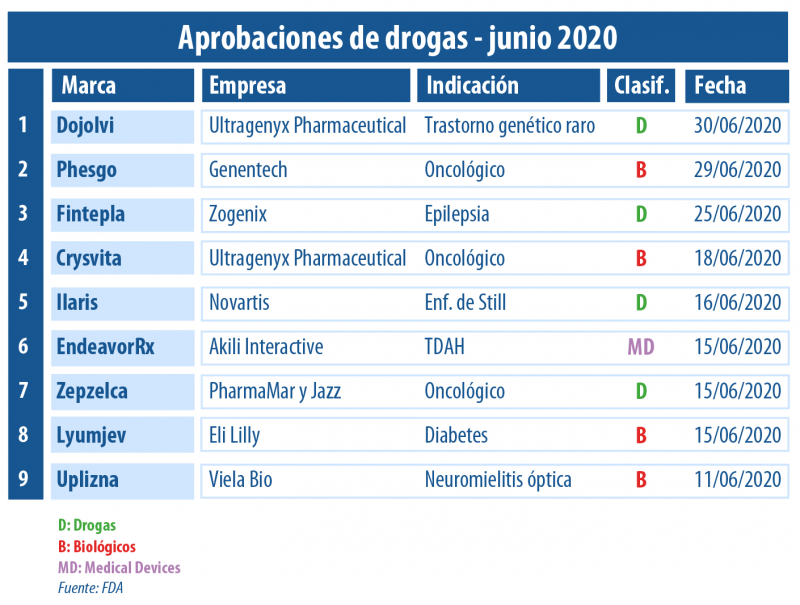
Por caso, el organismo autorizó a Uplizna de Viela Bio, un laboratorio que surgió como un spin-off de la británica AstraZeneca. Es un biológico intravenoso para el desorden del espectro de neuromielitis óptica en adultos con un anticuerpo particular. Esta etiqueta saldrá a competir en los Estados Unidos con Soliris de la norteamericana Alexion Pharmaceuticals. Ver artículo.
Asimismo, la entidad regulatoria le otorgó la venia a Lyumjev de Eli Lilly, indicado para el control glucémico en adultos con diabetes tipo 1 y tipo 2. Es una insulina de rápida acción con una formulación novel de insulin lispro -ya existente en Humalog, también propiedad de la multi-. Ver artículo.
Los biológicos en este sexto mes del 2020 tuvieron un lugar protagónico. La FDA le levantó el pulgar a las novedades Uplizna de Viela Bio; Phesgo de Genentech; y Lyumjev de Eli Lilly; y a una nueva indicación para Crysvita de Ultragenyx Pharmaceutical.
En la categoría de biológicos, Crysvita de la norteamericana Ultragenyx Pharmaceutical sumó un nuevo OK. Esta vez para tratar a niños desde los dos años de edad con osteomalacia tumoral. Así, el medicamento se convirtió en la primera terapia en recibir el visto bueno para esta rara enfermedad. Asimismo, al filo del cierre del mes el organismo avaló a otra etiqueta de la compañía. Le levantó el pulgar a Dojolvi, para niños y adultos con ciertos trastornos genéticos raros vinculados a la «oxidación de ácidos grasos» (LC-FAOD por sus siglas en inglés). Ver artículo. Ver press release.
En tanto, otra droga que obtuvo una nueva indicación fue Ilaris de la suiza Novartis. El anticuerpo monoclonal fue respaldado para la enfermedad de Still. De esta manera, el inyectable que había sido autorizado originalmente en el 2009, se constituyó como el primer tratamiento para esta rara y severa condición. Ver artículo.
El segundo oncológico en ser aprobado por la FDA fue Zepzelca, el que lleva el sello de la española PharmaMar y la irlandesa Jazz Pharmaceuticals. El mismo fue desarrollado como una terapia de segunda línea para un tipo específico de cáncer de pulmón. Ver artículo.
Para completar la tríada en el segmento de Onco se sumó Phesgo de la biotecnológica Genentech, del grupo suizo Roche. Es una inyección subcutánea de dosis fija, que combina Perjeta y Herceptin -ambos propiedad de la multi suiza- con Enhanze, de la firma Halozyme Therapeutics. Este biológico apunta a tratar el cáncer de mama HER2 positivo temprano y metastásico en adultos, en combinación con quimioterapia. Ver artículo.
En el último tramo del mes, también logró el sí Fintepla, del norteamericano Zogenix, para las convulsiones asociadas con el síndrome de Dravet, una forma rara y crónica de epilepsia. El medicamento estará disponible en el mercado de Estados Unidos a partir de finales de julio. Ver artículo.
Por el lado de los medical devices, recibió luz verde EndeavorRx de la norteamericana Akili Interactive. Es el primer tratamiento digital destinado a mejorar los síntomas asociados al TDAH. Además, se constituyó en el primer dispositivo basado en un videojuego en ser aprobado para cualquier tipo de condición. Ver artículo.