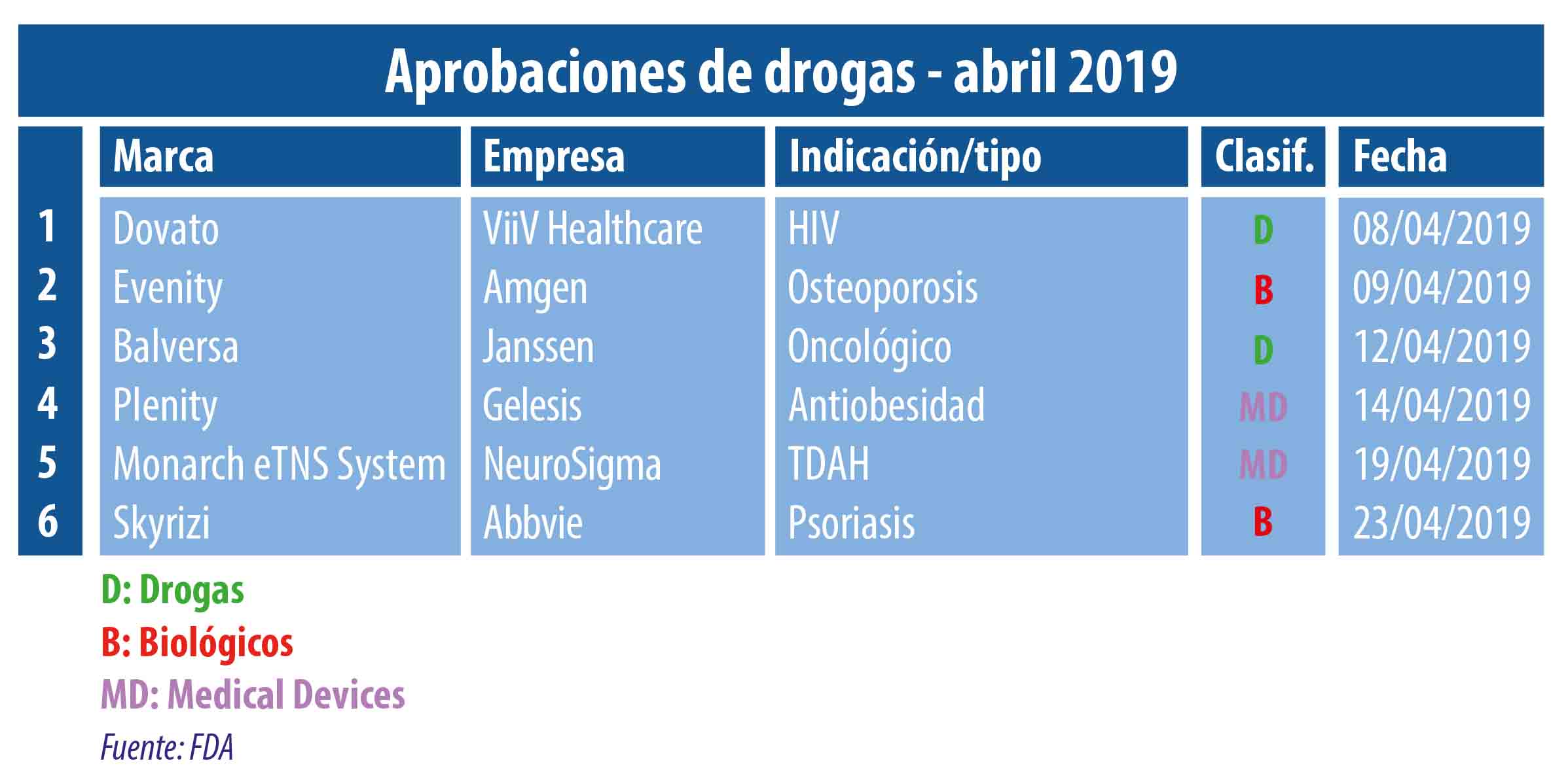
El cuarto mes del año se mostró súper activo en materia de aprobaciones por parte de la FDA. Por caso se destacó el aval para Skyrizi, un biológico que pertenece a la norteamericana Abbvie y que se suma a su cartera de productos para psoriasis donde se destaca su blockbuster Humira.
El cuarto mes del año llegó a su fin y Pharmabiz realizó un resumen de las principales aprobaciones que otorgó la FDA en este período. Ver infografía.
Así por caso la que se destacó fue la norteamericana Amgen que obtuvo luz verde para su biológico Evenity. El mismo está indicado para tratar la osteoporosis en mujeres posmenopáusicas que tengan alto riesgo de fractura ósea. Aunque se comercializará con una advertencia en el envase debido a los riesgos cardíacos que puede provocar. Ver artículo.
Otro biológico que recibió el OK de la FDA fue Skyrizi, el que lleva el sello de la norteamericana Abbvie y que promete convertirse en un producto estrella para psoriasis. El medicamento se suma al portafolio que incluye a su blockbuster Humira cuya indicación para esta enfermedad es una de las que le genera mejores resultados. Ver artículo.
La FDA también le levantó el pulgar a Plenity, un dispositivo antiobesidad que se constituye en un eslabón intermedio entre un fármaco y un device típico como los balones gástricos. El mismo funciona como una píldora súperabsorbente que aumenta el volumen del estómago.
En paralelo el organismo le levantó el pulgar a Balversa, un oncológico de Janssen que fue catalogado como la primera terapia dirigida para adultos con cáncer de vejiga metastásico que presentan cierta mutación genética. El producto fue avalado junto a un test de diagnóstico complementario para detectar quiénes son candidatos a recibir el tratamiento. Ver artículo.
En abril la agencia norteamericana también le dio el visto bueno a Dovato, el que combina dos moléculas previamente aprobadas y que está indicado para adultos con HIV que nunca han recibido tratamiento antirretroviral. El medicamento, que es el primer régimen completo en base a dos drogas -frente al standard que es de tres-, lleva el sello de ViiV Healthcare, la firma británica que pertenece a Pfizer y GSK. Ver artículo.
En la categoría de los medical devices, la FDA aprobó un dispositivo antiobesidad que se constituye en un eslabón intermedio entre un fármaco tradicional y un device típico como los balones gástricos. Se trata de Plenity, de la firma Gelesis, una píldora que contiene un hidrogel absorbente, el que aumenta el volumen del estómago a fin de encontrar satisfacción al comer. Ver artículo.
Asimismo el organismo le dio luz verde a Monarch eTNS System, el primer tratamiento no farmacológico para el trastorno por déficit de atención e hiperactividad, TDAH. El producto, de NeuroSigma, está indicado para niños de 7 a 12 años que actualmente no reciben terapias de prescripción. Ver artículo.