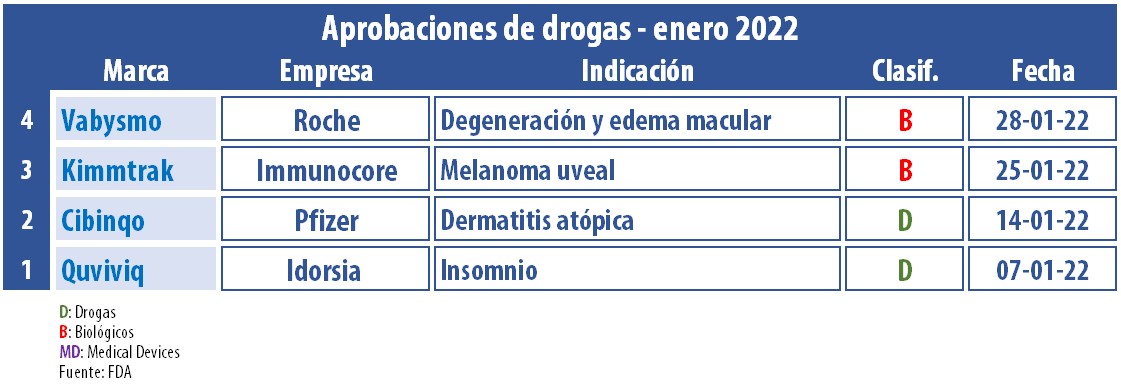
En el arranque de este año la FDA siguió activa, aunque con un menor ritmo de aprobaciones de nuevos productos. En lo que va del invierno del hemisferio norte, la agencia le dio el OK a un total de cuatro terapias.
El 2022 ya se ganó el título como el tercer año de pandemia, protagonizado -hasta el momento- por la variante Omicron. Sin embargo, la lupa de la FDA no está puesta solo en los productos para el COVID-19, sino también en otros negocios.
En el segmento de Onco se anotó un aval. Fue para Kimmtrak, de la biotecnológica británica Immunocore, la que está enfocada en una nueva clase de inmunoterapias biespecíficas con receptor de células T (TCR). De acuerdo con la firma, liderada por John Bell, este biológico es el único tratamiento respaldado por la FDA para el melanoma uveal no resecable o metastásico (mUM), y también el primer TCR terapéutico. Press Release Immunocore.
A su vez, durante el primer mes del año, la agencia regulatoria le dio luz verde a Cibinqo, de la norteamericana Pfizer. El producto, que se comercializará en tabletas de uso diario, está indicado para adultos con dermatitis atópica moderada a severa y cuyos síntomas no mejoran con el uso de otros medicamentos. Los comprimidos estarán disponibles en presentaciones de 100 mg. y 200 mg. a base de abrocitinib. Ver Press Release Pfizer.
El organismo también le dio el visto bueno a Quviviq, un tratamiento oral para adultos con insomnio, desarrollado por la suiza Idorsia. Se trata de la primera aprobación que la compañía obtiene, desde que surgió en el 2017 como un spin-off de la suiza Actelion, cuando esta fue adquirida por la norteamericana J&J. Según se precisó, Quviviq estará disponible en los Estados Unidos a partir de mayo de este año. Ver Press Release Idorsia / Ver artículo: «J&J completa deal, Actelion».
A la lista de enero se sumó a su vez el OK concedido a Vabysmo, que tiene el sello de Genentech, del grupo suizo Roche. El producto es el primer anticuerpo bioespecífico de Cuidado Ocular, indicado para el tratamiento de la degeneración macular asociada a la edad (AMD) húmeda o neovascular y para el edema macular diabético (DME). Así, se constituye como el único inyectable ocular avalado por la FDA simultáneamente para ambas condiciones. Ver Press Release Genentech.