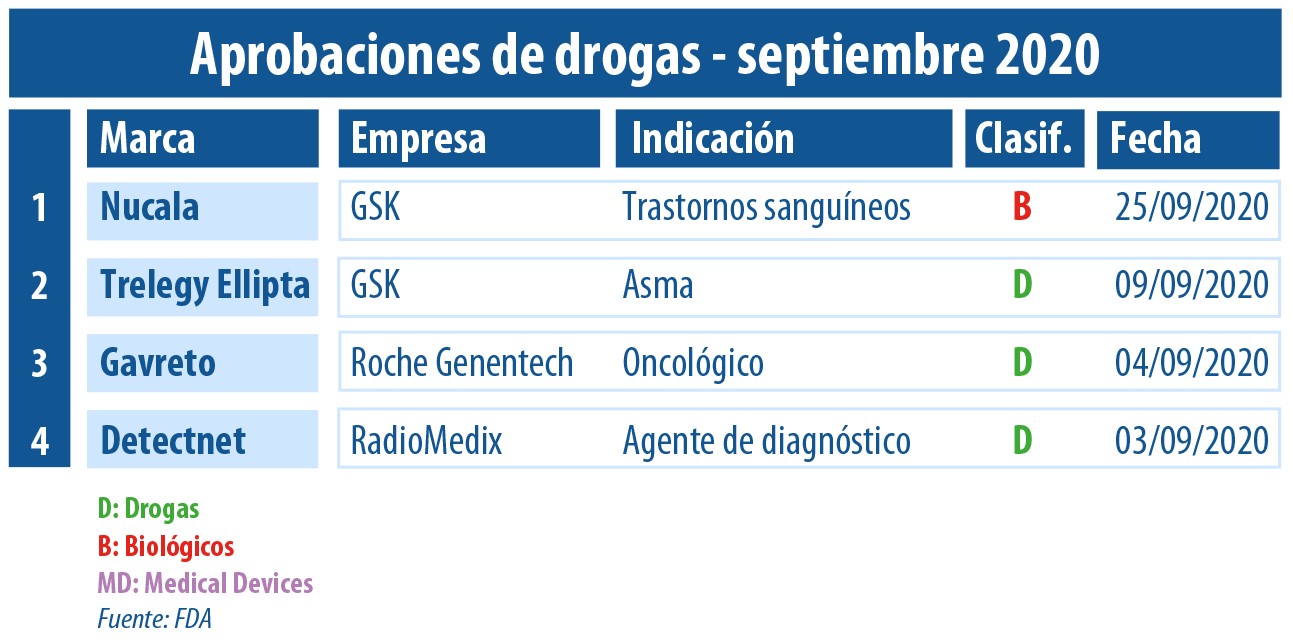
En este septiembre marcado por la pandemia del COVID-19 a nivel mundial, la FDA le dio luz verde a una reducida tanda de novedades extra coronavirus. Se destacaron los avales a dos nuevas moléculas. Además, dos terapias de GSK consiguieron nuevas indicaciones.
El noveno mes de este 2020 llegó a su fin y el equipo de Pharmabiz vuelve con su resumen que refleja las principales aprobaciones otorgadas por el organismo regulatorio norteamericano en este período.
Por caso, la FDA le concedió el visto bueno a Gavreto, el que lleva el sello de la biotecnológica Genentech -parte del grupo suizo Roche-. El producto, indicado para el tratamiento de adultos con cáncer de pulmón metastásico de células no pequeñas, se constituyó como el sexto medicamento de la cartera de Genentech avalado para cáncer de pulmón. Ver artículo.
Asimismo, la agencia le levantó el pulgar al inyectable Detectnet de la norteamericana RadioMedix. Se trata de un agente de diagnóstico radioactivo que se utiliza en tomografías por emisión de positrones -PET- para la detección de tumores neuroendocrinos. El mismo será comercializado en los Estados Unidos por Curium Pharma. Ver Press release.
El organismo también le dio luz verde a dos nuevas indicaciones, ambas para medicamentos pertenecientes a la británica GSK. Por un lado, la que obtuvo un segundo OK fue su terapia triple Trelegy Ellipta. Ahora, además de para EPOC, fue aprobada para el tratamiento del asma en adultos. Así se convirtió en el primer inhalador de dosis diaria 3 en 1, que simplifica el tener que usar múltiples dispositivos durante el día. Ver artículo.
Y el segundo en llevarse un nuevo visto bueno fue el biológico Nucala. El producto de la multi -avalado por primera vez en 2015 para personas con asma severa eosinofílica– ahora consiguió el pulgar arriba para un grupo de trastornos sanguíneos raros bautizado síndrome hipereosinofílico (HES). Ver artículo.