Las enfermedades ultra raras o para las que aún no existen tratamientos autorizados permanecen bajo la lupa de la FDA. Además, devices diseñados a partir de tecnologías disruptivas, como realidad aumentada inmersiva, se consolidan en su agenda.
A un mes de terminar el año, la FDA aprobó un amplio abanico de productos. Sin embargo, aún en el contexto de pandemia, en este período no otorgó nuevos avales relacionados con el COVID-19.
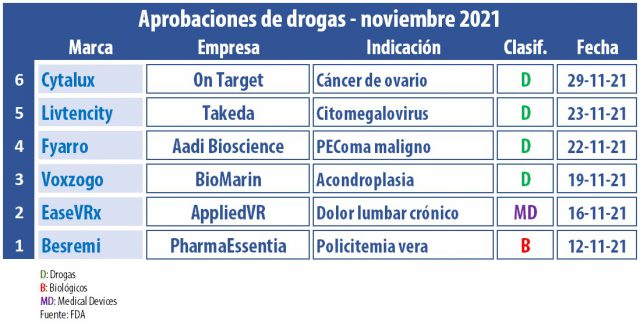
En noviembre, el organismo regulatorio le levantó el pulgar al primer tratamiento diseñado para favorecer el crecimiento de niños con acondroplasia, el tipo más frecuente de enanismo. Se trata de Voxzogo, un inyectable que lleva el sello de la norteamericana BioMarin. El mismo está indicado para mayores de cinco años con epífisis abiertas, es decir, que aún tienen el potencial de crecer. Ver artículo: «FDA aprobó Voxzogo, enanismo».
Por otro lado, la japonesa Takeda consiguió el visto bueno para Livtencity, un antiviral a base de maribavir. El producto apunta a mayores de 12 años con enfermedad por citomegalovirus (CMV) postrasplante. Livtencity, que se posicionó como el primer medicamento para esta infección, fue avalado por la FDA bajo revisión prioritaria, a la vez que obtuvo la designación de terapia disruptiva. Ver artículo: «FDA aprueba Livtencity, Takeda».
La agencia le dio luz verde también al biológico Besremi, de la taiwanesa PharmaEssentia. Según se informó, el inyectable a base de interferón alpha es el primero desarrollado específicamente para adultos con policitemia vera, un cáncer de sangre súper raro. Además, se precisó que el medicamento puede ser usado sin importar el historial médico de las personas. Ver artículo: «FDA aprueba Besremi, PharmaEssentia».
Otro oncológico que ganó el OK este mes fue Fyarro, de la norteamericana Aadi Bioscience. Es un inyectable indicado para adultos con cáncer de células epitelioides perivasculares, localmente avanzado irresecable o metastásico, conocido como PEComa. De acuerdo con la empresa, se ubica como la primera y única alternativa para esta enfermedad ultra-rara y agresiva. Fue avalado mediante revisión prioritaria y por vía rápida, y obtuvo la designación de terapia innovadora y de droga huérfana. Ver artículo: «FDA: luz verde a Fyarro, Onco».
Además, la norteamericana On Target Laboratories consiguió la aprobación de Cytalux, un indicador visual, diseñado para ayudar a los cirujanos a identificar lesiones de cáncer de ovario durante una intervención quirúrgica. Se trata de un agente de imágenes fluorescentes dirigido, que ilumina y facilita la visualización de los tejidos. Cytalux obtuvo la designación de droga huérfana, y fue avalado mediante revisión prioritaria y vía rápida. Ver artículo: «FDA: Cytalux con OK, diagnóstico Onco».
En el wing de los medical devices, el organismo regulatorio respaldó a EaseVRx, un sistema de realidad virtual inmersiva (VR) de uso prescriptivo. A través de una terapia cognitivo-conductual, este desarrollo de la norteamericana AppliedVR apunta a reducir los trastornos de adultos con dolor lumbar crónico, e irrumpe entre las alternativas actuales, tales como analgésicos recetados y de venta libre; ejercicio; e inyecciones de esteroides, entre otras. Ver artículo: «FDA aprueba sistema de realidad virtual».